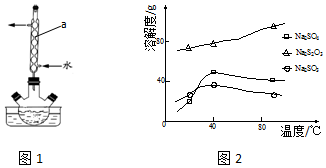
题目内容
14.某太阳能电池的工作原理如图所示.则光照时,失去电子的粒子是( )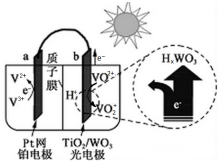
| A. | V2+ | B. | V3+ | C. | VO2+ | D. | VO2+ |
分析 由图可知b极上VO2+失电子发生氧化反应,b极反应为VO2++H2O-e-=VO2++2H+,由此分析解答.
解答 解:由图可知b极上VO2+失电子发生氧化反应,b极反应为VO2++H2O-e-=VO2++2H+,所以失去电子的粒子是VO2+,故选C.
点评 本题考查原电池知识,侧重于原电池的工作原理的考查,注意把握电极反应的判断,通过化合价的变化来分析判断失电子的微粒,为解答该类题目的关键,难度不大.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
4.下列各组离子中,能大量共存且加入(或通入)X试剂后发生反应的离子方程式对应正确的是( )
| 选项 | 离子组 | 试剂X | 离子方程式 |
| A | Fe3+、Al3+、SiO32-、NO3- | 过量的盐酸 | SiO32-+2H+=H2SiO3↓ |
| B | 透明溶液中:Fe3+、NH4+、SO42-、Cl- | 过量的铜粉 | 2Fe3++Cu=2Fe2++Cu2+ |
| C | Na+、Ba+、HCO3-、Cl- | NaHSO4溶液 | H++HCO3-=CO2↑+H2O |
| D | pH=1的溶液中:Mg2+、Fe2+、NO3-、SO42- | 双氧水 | 2Fe2++H2O2+2H+=2Fe3++2H2O |
| A. | A | B. | B | C. | C | D. | D |
5.在甲、乙、丙三个不同密闭容器中,按不同方式投料,起始浓度和起始容积相同,一定条件下发生反应:N2(g)+3H2(g)?2NH3(g)△H<0.相关数据如表所示:下列说法正确的是( )
| 容器 | 甲 | 乙 | 丙 |
| 相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
| 反应物投料n | 1mol N2、3mol H2 | 2mol NH3 | 2mol NH3 |
| 平衡时容器体积/L | V甲 | V乙 | V丙 |
| 反应的平衡常数K | K甲 | K乙 | K丙 |
| 平衡时NH3的浓度/mol•L-1 | c甲 | c乙 | c丙 |
| 平衡时NH3的反应速率/mol•L-1•min-1 | v甲 | v乙 | v丙 |
| A. | V甲>V乙 | B. | K丙>K乙 | C. | V甲=V丙 | D. | c乙>c甲 |
19.氦通常被认为无法形成化合物.直到近几年,随着计算化学的发展,研究人员通过“晶体结构预测”模型进行演算发现,一定条件下能够得到氦钠化合物.经进一步实验,合成得到Na2He.下列说法不正确的是( )
| A. | Na2He中各微粒的最外层电子均达到稳定结构 | |
| B. | 合成Na2He不可能在常温常压下进行 | |
| C. | 定量研究的方法能够促进化学科学的发展 | |
| D. | He与H具有相同的电子层结构 |
7.以下说法正确的是( )
| A. | 同分异构体之间分子式相同,其相对分子质量也一定相等,则相对分子质量相等的物质一定是同分异构体 | |
| B. | 同分异构体之间某种元素的质量分数均相同,化合物之间某种元素质量分数均相同的物质一定为同分异构体 | |
| C. | 两种物质如果互为同分异构体,则一定不可能为同系物 | |
| D. | 两种物质如果互为同分异构体,则它们的命名可能一样 |
4.赤铜矿的成分是Cu2O,辉铜矿的成分是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:Cu2S+2Cu2O$\frac{\underline{\;\;△\;\;}}{\;}$6Cu+SO2↑.对于该反应的下列说法正确的是( )
| A. | 该反应中的氧化剂只有Cu2O | |
| B. | Cu2S在反应中既是氧化剂又是还原剂 | |
| C. | Cu既是氧化产物又是还原产物 | |
| D. | 生成1 mol Cu,转移2 mol电子 |
5.化学与人类生产、生活密切相关,下列有关说法不正确的是( )
| A. | 将“地沟油”变废为宝,可制成生物柴油和肥皂 | |
| B. | 福尔马林可浸制标本,利用了其使蛋白质变性的性质 | |
| C. | “海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化 | |
| D. | 绚丽缤纷的烟花中添加了含钾、钠、钙、铜等金属元素的化合物 |