题目内容
7.以下说法正确的是( )| A. | 同分异构体之间分子式相同,其相对分子质量也一定相等,则相对分子质量相等的物质一定是同分异构体 | |
| B. | 同分异构体之间某种元素的质量分数均相同,化合物之间某种元素质量分数均相同的物质一定为同分异构体 | |
| C. | 两种物质如果互为同分异构体,则一定不可能为同系物 | |
| D. | 两种物质如果互为同分异构体,则它们的命名可能一样 |
分析 A.相对分子质量相等的物质不一定具有相同分子式;
B.化合物之间某种元素质量分数均相同的物质不一定具有相同分子式,如不同C的烯烃中C、H质量分数相等;
C.同系物之间分子式一定不同,则一定不互为同分异构体;
D.同分异构体结构不同,则命名一定不同.
解答 解:A.同分异构体必须具有相同分子式,而相对分子质量相等的物质不一定具有相同分子式,则不一定互为同分异构体,故A错误;
B.同分异构体之间某种元素的质量分数均相同,但化合物之间某种元素质量分数均相同的物质不一定为同分异构体,如烯烃通式为CnH2n,C不同时C、H的质量分数都相同,它们之间互为同系物,不属于同分异构体,故B错误;
C.两种物质如果互为同分异构体,说明二者具有相同分子式,而同系物之间相差1个或n个CH2原子团,则二者一定不可能为同系物,故C正确;
D.两种物质如果互为同分异构体,物质不同,则命名一定不同,故D错误;
故选C.
点评 本题考查同系物、同分异构体的判断,题目难度不大,明确概念为解答关键,注意掌握同系物与同分异构体的区别,试题培养了学生的灵活应用能力.

练习册系列答案
 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
16.下列关于有机化合物的说法正确的是( )
| A. | 乙醇能发生取代反应和加成反应 | |
| B. | 1mol 3-(2-噻吩)丙烯酸(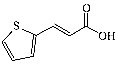 )发生加成反应时最多消耗3mol H2 )发生加成反应时最多消耗3mol H2 | |
| C. | 淀粉和纤维素的分子通式均为(C6H10O5)n,故淀粉和纤维素互为同分异构体 | |
| D. | 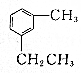 与 与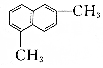 都属于芳香烃,二者互为同系物 都属于芳香烃,二者互为同系物 |
17.25℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)CH3COOH、H2CO3、HC1O的酸性由强到弱的顺序为CH3COOH>H2CO3>HC1O.
(2)写出H2CO3的电离方程式:H2CO3?HCO3-+H+,HCO3-?CO32-+H+.
(3)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是A(填宇母序号,下同).
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$
C.c(H+)•c(OH-) D.$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$
若该溶液升髙温度,上述4种表达式的数据增大的是ABCD.
(4)取0.10mol CH3COOH (冰醋酸)作导电性实验,测得其导电率随加入的水量变化如图所示:比较a、b点的相关性质(填“>”“<”或“=”):
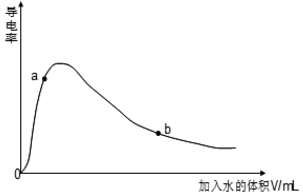
n(H+):a<b;c(CH3COO-):a>b;完全中和时消耗NaOH的物质的量:a=b;
(5)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分別与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是③④(填写序号)
①反应所需要的时间B>A ②开始反应时的速率A>B
③参加反应的锌的物质的量A=B ④A中有锌剩余.
| 化学式 | CH3COOH | H2CO3 | HC1O |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10 K2=5.6×10-11 | 3.0×10-8 |
(1)CH3COOH、H2CO3、HC1O的酸性由强到弱的顺序为CH3COOH>H2CO3>HC1O.
(2)写出H2CO3的电离方程式:H2CO3?HCO3-+H+,HCO3-?CO32-+H+.
(3)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是A(填宇母序号,下同).
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$
C.c(H+)•c(OH-) D.$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$
若该溶液升髙温度,上述4种表达式的数据增大的是ABCD.
(4)取0.10mol CH3COOH (冰醋酸)作导电性实验,测得其导电率随加入的水量变化如图所示:比较a、b点的相关性质(填“>”“<”或“=”):

n(H+):a<b;c(CH3COO-):a>b;完全中和时消耗NaOH的物质的量:a=b;
(5)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分別与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是③④(填写序号)
①反应所需要的时间B>A ②开始反应时的速率A>B
③参加反应的锌的物质的量A=B ④A中有锌剩余.
14.某太阳能电池的工作原理如图所示.则光照时,失去电子的粒子是( )


| A. | V2+ | B. | V3+ | C. | VO2+ | D. | VO2+ |
2. 化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率.
(已知:S2O32-+2H+=H2O+S↓+SO2↑)
(1)为保证实验准确性、可靠性,利用该装置进行实验前应先进行的步骤是检查装置的气密性;除如图所示的实验用品、仪器外,还需要的一件实验仪器是秒表.
(2)若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内H+的反应速率,而该测定值比实际值偏小,其原因是SO2会部分溶于水,导致所测得SO2体积偏小.
(3)试简述测定该反应的化学反应速率的其他方法(写一种):测定一段时间内生成硫单质的质量或测定一定时间内溶液H+浓度的变化
Ⅱ.为探讨化学反应速率的影响因素,设计的实验方案如下表.
(已知 I2+2S2O32-=S4O62-+2I-,其中Na2S2O3溶液均足量)
(4)该实验进行的目的是探究反应物浓度(Na2S2O3)对化学反应速率的影响;,表中Vx=4 mL,比较t1、t2、t3大小,试推测该实验结论:t1<t2<t3.
 化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率.
(已知:S2O32-+2H+=H2O+S↓+SO2↑)
(1)为保证实验准确性、可靠性,利用该装置进行实验前应先进行的步骤是检查装置的气密性;除如图所示的实验用品、仪器外,还需要的一件实验仪器是秒表.
(2)若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内H+的反应速率,而该测定值比实际值偏小,其原因是SO2会部分溶于水,导致所测得SO2体积偏小.
(3)试简述测定该反应的化学反应速率的其他方法(写一种):测定一段时间内生成硫单质的质量或测定一定时间内溶液H+浓度的变化
Ⅱ.为探讨化学反应速率的影响因素,设计的实验方案如下表.
(已知 I2+2S2O32-=S4O62-+2I-,其中Na2S2O3溶液均足量)
| 实验序号 | 体积V/mL | 时间/s | |||
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
| ① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
12.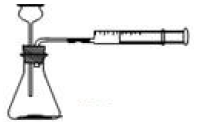 甲同学用0.1×10×25mm、质量分数≥99.5%的铝片和盐酸用下图装置反应制取H2,实验现象如表:
甲同学用0.1×10×25mm、质量分数≥99.5%的铝片和盐酸用下图装置反应制取H2,实验现象如表:
(1)写出上述铝与盐酸反应的离子方程式2Al+6H+=2Al3++3H2↑.
(2)实验开始1min内反应速率很慢,原因是温度低,铝片表面的三氧化二铝先和盐酸反应没有气体生成
(3)反应1~15min内,反应速率逐渐加快,原因是反应放热,温度升高.
(4)反应10min时注射器读数为448mL(假设为标准状况),则注射器中氢气的物质的量浓度为0.04mol/L.用氢气表示的化学反应速率为0.004mol/(L•min)(1/22.4=0.04)
(5)乙同学认为用铝粉代替铝片实验效率更高,原因是_铝粉与盐酸接触面积更大,反应速率加快
(6)丙同学认为甲、乙两位同学收集的氢气都不纯,含有杂质的化学式为HCl,H2O.
 甲同学用0.1×10×25mm、质量分数≥99.5%的铝片和盐酸用下图装置反应制取H2,实验现象如表:
甲同学用0.1×10×25mm、质量分数≥99.5%的铝片和盐酸用下图装置反应制取H2,实验现象如表: | 1min | 2min | 5min | 15min | 20min |
| 3mol•L-1HCl | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
(2)实验开始1min内反应速率很慢,原因是温度低,铝片表面的三氧化二铝先和盐酸反应没有气体生成
(3)反应1~15min内,反应速率逐渐加快,原因是反应放热,温度升高.
(4)反应10min时注射器读数为448mL(假设为标准状况),则注射器中氢气的物质的量浓度为0.04mol/L.用氢气表示的化学反应速率为0.004mol/(L•min)(1/22.4=0.04)
(5)乙同学认为用铝粉代替铝片实验效率更高,原因是_铝粉与盐酸接触面积更大,反应速率加快
(6)丙同学认为甲、乙两位同学收集的氢气都不纯,含有杂质的化学式为HCl,H2O.
19.已知25℃物质的溶度积常数为:FeS:Ksp=6.3×10-18;CuS:Ksp=1.3×10-36;ZnS:Ksp=1.6×10-24.下列说法正确的是( )
| A. | 相同温度下,CuS的溶解度小于ZnS的溶解度 | |
| B. | 除去工业废水中的Fe2+,可以选用CuS做沉淀剂 | |
| C. | 足量CuSO4溶解在0.1mol/L的H2S溶液中,Cu2+能达到的最大浓度为1.3×10-35mol/L | |
| D. | 在ZnS的饱和溶液中,加入FeCl2溶液,一定不产生FeS沉淀 |
17.NA代表阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 100mL4mol/L的硫酸与足量Cu共热,转移的电子数为0.4NA | |
| B. | 1L 0.1mol•L-1的Na2CO3溶液中含有阳离子的总数为0.2NA | |
| C. | O2和O3的混合物共3.2g,其中所含氧原子数一定为0.2NA | |
| D. | 室温时,pH=12的Ba(OH)2溶液中,氢氧根离子数目为10-2NA |
