题目内容
9.甲同学进行了FeCl2溶液的配制、浓度的测定以及Fe2+还原性的实验,并针对异常现象进行探究.步骤一:甲同学准备用两种方案制取FeCl2.
方案1:按如图装置用H2还原无水FeCl3制取.
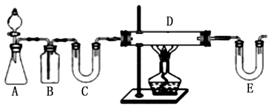
(1)E中盛放的试剂是碱石灰;D中反应的化学方程式为H2+2FeCl3=2FeCl2+2HCl.
方案2:由0.1mol•L-1 FeCl3溶液制取FeCl2溶液,
(2)写出完成上述操作所涉及的离子方程式2Fe3++Fe=3Fe2+.
步骤二:用重铬酸钾法测定方案2所配FeCl2溶液的物质的量浓度.
(3)①若需配制浓度为0.01000mol•L-1的K2Cr2O7标准溶液480mL,实验中用到的玻璃仪器有量筒、玻璃棒、烧杯,还缺少500mL容量瓶,胶头滴管.
②本实验滴定过程中操作滴定管的图示正确的是A(填编号).

③下列错误的操作使测定的FeCl2溶液浓度偏小的是A
a.若在配制K2Cr2O7标准溶液定容时采取俯视姿势
b.若滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失.
c.锥形瓶洗净后未干燥
步骤三:向2mL FeCl2溶液中滴加2滴0.1mol•L-1KSCN溶液,无现象;再滴加5滴5% H2O2溶液(pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2).
(4)甲同学探究“步骤三”中溶液褪色的原因:
实验I.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
实验II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀,并测得生成了两种可直接排放到空气中的气体.
实验III.向2mL 0.1mol•L-1 FeCl3溶液中滴加2滴0.1mol•L-1KSCN溶液,变红,通入O2,无明显变化.
①实验I说明溶液红色褪去是因为SCN-发生了反应而不是Fe3+发生反应.
②实验III的目的是排除H2O2分解产生的O2氧化SCN-的可能.
得出结论:溶液褪色的原因是酸性条件下H2O2将SCN-氧化成SO42-和相关气体.写出该反应的离子方程式2SCN-+11H2O2═2SO42-+2H++2CO2↑+N2↑+10H2O.
分析 步骤一:(1)方案1:按如图中装置可知,用H2还原无水FeCl3制取无水FeCl2,A装置一般用锌和稀盐酸制备H2,B装置用来除去氢气中的氯化氢,C装置用来干燥氢气,可以装置碱石灰,E装置中也要装置碱石灰,吸收氯化氢气体同时防止空气中的水份进入D装置,D装置中用氢气与氯化氯生成氯化亚铁;
(2)方案2:由FeCl3溶液制取FeCl2溶液,可以在氯化铁溶液中加入足量铁粉;
(3)步骤二:根据配制一定物质的量浓度溶液的操作步骤可知,配制溶液是需要500 mL容量瓶、胶头滴管、量筒、玻璃棒、烧杯等,在操作滴定管时应用左手握住活塞,手指在另上侧拧开活塞,根据氧化还原滴定原理可以进行误差分析;
(4)步骤三:根据实验步骤可知,实验III的目的是排除H2O2分解产生的O2氧化SCN-的可能,在酸性条件下H2O2将SCN-氧化成SO42-和氮气,同时有二氧化碳生成,据此书写离子方程式.
解答 解:步骤一:(1)方案1:按如图中装置可知,用H2还原无水FeCl3制取无水FeCl2,A装置一般用锌和稀盐酸制备H2,B装置用来除去氢气中的氯化氢,C装置用来干燥氢气,可以装置碱石灰,E装置中也要装置碱石灰,吸收氯化氢气体同时防止空气中的水份进入D装置,D装置中用氢气与氯化氯生成氯化亚,所以E中盛放的试剂是 碱石灰,D中反应的化学方程式为 H2+2FeCl3=2FeCl2+2HCl;
故答案为:碱石灰;H2+2FeCl3=2FeCl2+2HCl;
(2)方案2:由FeCl3溶液制取FeCl2溶液,可以在氯化铁溶液中加入足量铁粉,反应为:2Fe3++Fe=3Fe2+;
故答案为:2Fe3++Fe=3Fe2+;
(3)步骤二:①根据配制一定物质的量浓度溶液的操作步骤可知,配制溶液是需要500 mL容量瓶、胶头滴管、量筒、玻璃棒、烧杯等,在操作滴定管时应用左手握住活塞,手指在另上侧拧开活塞,故选 A;
故答案为:500 mL容量瓶、胶头滴管;A;
②在氧化还原滴定中:
A.若在配制K2Cr2O7标准溶液定容时采取俯视姿势,会使标准液的浓度偏高,导致消耗的标准液的体积偏小,会使测定的FeCl2溶液浓度偏小,故A正确;
B.若滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,使标准液的体积偏大,会使测定的FeCl2溶液浓度偏大,故B错误;
C.锥形瓶洗净后未干燥,对实验没有影响,故选A;
故答案为:A;
(4)步骤三:②根据实验步骤可知,实验III的目的是排除H2O2分解产生的O2氧化SCN-的可能;
在酸性条件下H2O2将SCN-氧化成SO42-和氮气,同时有二氧化碳生成,反应的离子方程式为2SCN-+11H2O2═2SO42-+2H++2 CO2↑+N2↑+10 H2O;
故答案为:排除H2O2分解产生的O2氧化SCN-的可能;2SCN-+11H2O2═2SO42-+2H++2 CO2↑+N2↑+10 H2O.
点评 本题考查物质的有关性质以及离子之间的转化、实验过程分析及实验基本操作,主要是物质性质和离子检验的理解应用,题目难度中等.

 |  |  |  |
| 古代与现代的冶金均运用了相同的化学原理 | 古代与现代的火箭发射均利用了液体燃料 | 古代捣碎中药与现代中药纳米粉碎均是化学变化 | 古代风筝与现代热气球飞行均无需物质直接供给能量 |
| A. | A | B. | B | C. | C | D. | D |

(1)基态碳(C)原子的电甲排布图为
 .
.(2)[Cr(H20)4Cl2]•2H2O 中Cr的配位数为6.
(3)与铜属于同一周期,且未成对电子数最多的元素基态原子价层电子排布式为3d54s1.
(4)Fe的一种晶胞结构如甲、乙所示,若按甲中虚线方向切乙得到的A〜D图中正确的是A.
(5)据报道,只含镁、镍和碳三种元素的晶体具 有超导性.鉴于这三种元素都是常见元素,从而引起广泛关注.该晶体的晶胞结构如下图所示,晶体中每个镁原子周围距离最近的镍原子有12个,试写出该晶体的化学式MgCNi3.
(6)根据下列五种元素的第一至第四电离能数据(单位:kJ•mol-1),回答下列问题.
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2 080 | 4 000 | 6 100 | 9 400 |
| R | 500 | 4 600 | 6 900 | 9 500 |
| S | 740 | 1 500 | 7 700 | 10 500 |
| T | 580 | 1 800 | 2 700 | 11 600 |
| U | 420 | 3 100 | 4 400 | 5 900 |
②T元素最可能是P区元素.若T为第二周期元素,F.是第三周期元素中原子半径最小的元素,则T、F形成的化合物的空间构型为平面三角形,其中心原子的杂化方式为sp2.
| 化学式 | CH3COOH | H2CO3 | HC1O |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10 K2=5.6×10-11 | 3.0×10-8 |
(1)CH3COOH、H2CO3、HC1O的酸性由强到弱的顺序为CH3COOH>H2CO3>HC1O.
(2)写出H2CO3的电离方程式:H2CO3?HCO3-+H+,HCO3-?CO32-+H+.
(3)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是A(填宇母序号,下同).
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$
C.c(H+)•c(OH-) D.$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$
若该溶液升髙温度,上述4种表达式的数据增大的是ABCD.
(4)取0.10mol CH3COOH (冰醋酸)作导电性实验,测得其导电率随加入的水量变化如图所示:比较a、b点的相关性质(填“>”“<”或“=”):
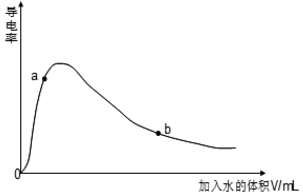
n(H+):a<b;c(CH3COO-):a>b;完全中和时消耗NaOH的物质的量:a=b;
(5)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分別与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是③④(填写序号)
①反应所需要的时间B>A ②开始反应时的速率A>B
③参加反应的锌的物质的量A=B ④A中有锌剩余.

| A. | V2+ | B. | V3+ | C. | VO2+ | D. | VO2+ |
 化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率.
(已知:S2O32-+2H+=H2O+S↓+SO2↑)
(1)为保证实验准确性、可靠性,利用该装置进行实验前应先进行的步骤是检查装置的气密性;除如图所示的实验用品、仪器外,还需要的一件实验仪器是秒表.
(2)若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内H+的反应速率,而该测定值比实际值偏小,其原因是SO2会部分溶于水,导致所测得SO2体积偏小.
(3)试简述测定该反应的化学反应速率的其他方法(写一种):测定一段时间内生成硫单质的质量或测定一定时间内溶液H+浓度的变化
Ⅱ.为探讨化学反应速率的影响因素,设计的实验方案如下表.
(已知 I2+2S2O32-=S4O62-+2I-,其中Na2S2O3溶液均足量)
| 实验序号 | 体积V/mL | 时间/s | |||
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
| ① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
| A. | 相同温度下,CuS的溶解度小于ZnS的溶解度 | |
| B. | 除去工业废水中的Fe2+,可以选用CuS做沉淀剂 | |
| C. | 足量CuSO4溶解在0.1mol/L的H2S溶液中,Cu2+能达到的最大浓度为1.3×10-35mol/L | |
| D. | 在ZnS的饱和溶液中,加入FeCl2溶液,一定不产生FeS沉淀 |
| A. | 95%的酒精用于医疗中可作消毒剂,硫酸钡用于医疗中可作钡餐 | |
| B. | 食品中用木糖醇作甜味剂,可降低糖尿病的犯病几率 | |
| C. | 焊接废旧钢材前,分别用饱和Na2CO3溶液、NH4Cl溶液处理焊点 | |
| D. | 钙基固硫和NOx的催化转化都是解决空气污染问题的措施 |