题目内容
下列有关电解质溶液中微粒浓度关系正确的是( )
| A、pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) |
| B、含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) |
| C、0.1 mol/L NH4Cl与0.1 mol/L氨水等体积混合(pH>7):c(NH3?H2O)>c(NH4+)>c(Cl-)>c(OH-) |
| D、含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A.根据硫酸氢钠溶液中的质子守恒判断;
B.由于氯化银和碘化银的溶度积不同,则溶液中氯离子和碘离子浓度不同;
C.0.1 mol/L NH4Cl与0.1 mol/L氨水等体积混合,混合液的pH>7,说明一水合氨的电离程度大于铵根离子的水解程度,则c(NH3?H2O)>c(NH4+),再根据物料守恒可得c(NH3?H2O)>c(Cl-)>c(NH4+);
D.根据混合液中的物料守恒分析.
B.由于氯化银和碘化银的溶度积不同,则溶液中氯离子和碘离子浓度不同;
C.0.1 mol/L NH4Cl与0.1 mol/L氨水等体积混合,混合液的pH>7,说明一水合氨的电离程度大于铵根离子的水解程度,则c(NH3?H2O)>c(NH4+),再根据物料守恒可得c(NH3?H2O)>c(Cl-)>c(NH4+);
D.根据混合液中的物料守恒分析.
解答:
解:A.pH=1的NaHSO4溶液中,氢离子来自硫酸和水的电离,则:c(H+)=c(SO42-)+c(OH-),故A正确;
B.含有AgCl和AgI固体的悬浊液中,氯化银的溶解度大于碘化银,则正确的离子浓度关系为:c(Ag+)>c(Cl-)>c(I-),故B错误;
C.0.1 mol/L NH4Cl与0.1 mol/L氨水等体积混合,得到等浓度的氯化铵和一水合氨,由于混合液的pH>7,说明一水合氨的电离程度大于铵根离子的水解程度,则c(NH3?H2O)>c(NH4+),根据物料守恒可得:c(NH3?H2O)>c(Cl-)>c(NH4+),故C错误;
D.等物质的量的NaHC2O4和Na2C2O4的溶液中,根据物料守恒可得:2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)],故D错误;
故选A.
B.含有AgCl和AgI固体的悬浊液中,氯化银的溶解度大于碘化银,则正确的离子浓度关系为:c(Ag+)>c(Cl-)>c(I-),故B错误;
C.0.1 mol/L NH4Cl与0.1 mol/L氨水等体积混合,得到等浓度的氯化铵和一水合氨,由于混合液的pH>7,说明一水合氨的电离程度大于铵根离子的水解程度,则c(NH3?H2O)>c(NH4+),根据物料守恒可得:c(NH3?H2O)>c(Cl-)>c(NH4+),故C错误;
D.等物质的量的NaHC2O4和Na2C2O4的溶液中,根据物料守恒可得:2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)],故D错误;
故选A.
点评:本题考查了溶液中离子浓度大小比较,题目难度中等,试题涉及难溶物溶度积、电荷守恒、物料守恒、盐的水解原理的应用,注意熟练掌握判断溶液中离子浓度大小常用方法.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
把铁和铜加入到氯化铁、氯化亚铁和氯化铜的混合溶液中,反应后铁有剩余则( )
| A、溶液中有Fe2+、Cu2+ |
| B、剩下的固体是Fe和Cu |
| C、溶液中有Fe3+、Fe2+ |
| D、剩下的固体是Fe,无Cu |
下列说法正确的是( )
| A、向饱和的碳酸钠溶液中通入CO2气体,没有明显实验现象 |
| B、向久置于空气中的FeSO4溶液中滴加NaOH溶液,产生大量白色沉淀 |
| C、在空气中用酒精灯加热铝箔,铝箔熔化,失去光泽,但熔化的铝并不滴落 |
| D、向某溶液中滴加盐酸后,有能使澄清石灰水变浑浊的无色无味气体产生,证明该溶液中一定含有CO32- |
相同温度下等物质的量浓度的下列溶液中,NH4+值最小的是( )
| A、NH4Cl |
| B、NH4HCO3 |
| C、NH4HSO4 |
| D、(NH4)2SO4 |
用NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
| A、1 mol NH3与1mol OH-所含的质子数均为10NA |
| B、常温下,pH=13的NaOH溶液中含OH-数目为NA |
| C、常温下,14g乙烯中含碳原子数为NA |
| D、标准状况下,22.4L CHCl3中含C-H键数目为NA |
室温下,将一元酸HA溶液和NaOH溶液等体积混合,实验数据如表:下列说法正确的是( )
| 实验编号 | 起始浓度c(HA) | 起始浓度c(NaOH) | 反应后溶液的pH |
| ① | 0.2mol?L-1 | 0.2mol?L-1 | 9 |
| A、HA是一元强酸 |
| B、反应后溶液中c(A-)>c(Na+) |
C、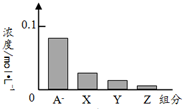 若用如图来表示反应后各微粒的关系,则图中X 表示OH-,Y表示HA,Z表示H+ |
| D、该混合溶液中:c(A-)+c(Y)>c(Na+) |