题目内容
实验室也可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:
2KMnO4+16HCl(浓)=2KCl+MnCl2+5Cl2↑+8H2O
(1)该反应中的氧化剂是
(2)该反应中HCl的作用是:
(3)如反应中转移了0.6mol电子,则产生的气体在标准状况下体积为 .
2KMnO4+16HCl(浓)=2KCl+MnCl2+5Cl2↑+8H2O
(1)该反应中的氧化剂是
(2)该反应中HCl的作用是:
(3)如反应中转移了0.6mol电子,则产生的气体在标准状况下体积为
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:由方程式可知,反应中Mn元素化合价由+7价降低到+2价,被还原,KMnO4为氧化剂,Cl元素化合价由-1价升高到0价,被氧化,HCl为还原剂,结合化合价的变化以及反应的方程式计算.
解答:
解:(1)反应中KMnO4为氧化剂,Mn元素的化合价由+7价降低到+2价,得到5个电子,Cl元素化合价升高,被氧化,故答案为:KMnO4;
(2)HCl反应生成KCl、MnCl2和Cl2,反应中盐酸表现为酸性和还原性,故答案为:酸性和还原性;
(3)Cl元素化合价由-1价升高到0价,由方程式可知,当生成5mol氯气时,转移10mol电子,如反应中转移了0.6mol电子,则产生0.3mol气体,体积为为0.3mol×22.4L/mol=6.72L,故答案为:6.72L.
(2)HCl反应生成KCl、MnCl2和Cl2,反应中盐酸表现为酸性和还原性,故答案为:酸性和还原性;
(3)Cl元素化合价由-1价升高到0价,由方程式可知,当生成5mol氯气时,转移10mol电子,如反应中转移了0.6mol电子,则产生0.3mol气体,体积为为0.3mol×22.4L/mol=6.72L,故答案为:6.72L.
点评:本题考查氧化还原反应,侧重于学生的分析能力和计算能力的考查,为高频考点,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案
相关题目
物质对应的用途(括号内是用途)错误的是( )
| A、单质硅(光导纤维) |
| B、钠钾合金(原子反应堆导热剂) |
| C、过氧化钠(潜水艇中供氧剂) |
| D、硫酸钡(医疗钡餐) |
下列有关电解质溶液中微粒浓度关系正确的是( )
| A、pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) |
| B、含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) |
| C、0.1 mol/L NH4Cl与0.1 mol/L氨水等体积混合(pH>7):c(NH3?H2O)>c(NH4+)>c(Cl-)>c(OH-) |
| D、含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
下列物质中,属于电解质的是( )
| A、NaOH | B、蔗糖 |
| C、稀盐酸 | D、NaCl溶液 |
区分氢氧化铁胶体与含酚酞的稀氢氧化钠混合溶液最简便有效的方法是( )
| A、滴加盐酸 | B、丁达尔效应 |
| C、过滤 | D、蒸馏 |
下列说法错误的是( )
| A、硝酸的摩尔质量和6.02×1023个硝酸分子的质量(以克为单位)在数值上相等 |
| B、6.02×10个氮气分子和6.02×1023个氢气分子的质量比等于14:1 |
| C、32g氧气所含的原子数目约为2×6.02×1023 |
| D、通常情况下,近似值6.02×1023就是我们所说的阿伏伽德罗常数 |
如图,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是( )
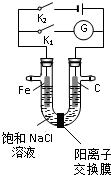

| A、K1闭合,铁棒侧溶液会出现白色沉淀,而且沉淀最终变为红褐色 |
| B、K1或K2闭合,石墨棒周围溶液pH均升高 |
| C、K2闭合,铁棒上发生的反应为2Cl--2e-=Cl2↑ |
| D、K2闭合,电路中通过0.002 NA个电子时,两极共产生0.002mol气体 |
 (1)将下列离子Na+、K+、Cu2+、H+、NO3-、Cl-、CO32-、OH-,按可能大量共存于同一溶液的情况,则分成A、B两组,而且每组中均含两种阳离子和两种阴离子,则A组
(1)将下列离子Na+、K+、Cu2+、H+、NO3-、Cl-、CO32-、OH-,按可能大量共存于同一溶液的情况,则分成A、B两组,而且每组中均含两种阳离子和两种阴离子,则A组