题目内容
下列说法正确的是( )
| A、向饱和的碳酸钠溶液中通入CO2气体,没有明显实验现象 |
| B、向久置于空气中的FeSO4溶液中滴加NaOH溶液,产生大量白色沉淀 |
| C、在空气中用酒精灯加热铝箔,铝箔熔化,失去光泽,但熔化的铝并不滴落 |
| D、向某溶液中滴加盐酸后,有能使澄清石灰水变浑浊的无色无味气体产生,证明该溶液中一定含有CO32- |
考点:钠的重要化合物,铝的化学性质,制取氢氧化铁、氢氧化亚铁
专题:
分析:A.碳酸氢钠的溶解度小于碳酸钠的溶解度;
B.向久置于空气中的FeSO4溶液中滴加NaOH溶液,生成白色沉淀迅速转化为灰绿色最后变化为红褐色沉淀;
C.氧化铝的熔点比铝的熔点高,包住了熔化的铝,所以加热铝箔的时候铝熔化了但是不会滴落;
D.溶液中也可能存在HCO3-等离子.
B.向久置于空气中的FeSO4溶液中滴加NaOH溶液,生成白色沉淀迅速转化为灰绿色最后变化为红褐色沉淀;
C.氧化铝的熔点比铝的熔点高,包住了熔化的铝,所以加热铝箔的时候铝熔化了但是不会滴落;
D.溶液中也可能存在HCO3-等离子.
解答:
解:A.向饱和碳酸钠溶液通入CO2气体,反应生成碳酸氢钠,碳酸氢钠的溶解度小于碳酸钠的溶解度,会产生沉淀,故A错误;
B.向久置于空气中的FeSO4溶液中滴加NaOH溶液,溶液中存在溶解的氧气,所以生成白色沉淀迅速转化为灰绿色最后变化为红褐色沉淀,故B错误;
C.铝箔在空气中被氧化为氧化铝,加热时,表面的氧化铝的熔点比铝的熔点高,包住了里边熔化的铝,所以加热铝箔的时候铝熔化了但是不会滴落,故C正确;
D.溶液中也可能存在HCO3-等离子,故D错误;
故选:C.
B.向久置于空气中的FeSO4溶液中滴加NaOH溶液,溶液中存在溶解的氧气,所以生成白色沉淀迅速转化为灰绿色最后变化为红褐色沉淀,故B错误;
C.铝箔在空气中被氧化为氧化铝,加热时,表面的氧化铝的熔点比铝的熔点高,包住了里边熔化的铝,所以加热铝箔的时候铝熔化了但是不会滴落,故C正确;
D.溶液中也可能存在HCO3-等离子,故D错误;
故选:C.
点评:本题考查了物质性质的分析应用,注意反应过程中的现象分析判断,掌握物质性质和化学反应是解题关键,题目难度中等.

练习册系列答案
相关题目
下列处置、操作或现象的描述中正确的是( )
①漂白粉露置在空气中保存
②金属镁着火时,可用CO2灭火
③让一束光通过胶体,会出现一条光亮的“通路”
④有大量的氯气泄漏时,应用浸有弱碱性溶液的毛巾捂住口鼻向高处跑.
①漂白粉露置在空气中保存
②金属镁着火时,可用CO2灭火
③让一束光通过胶体,会出现一条光亮的“通路”
④有大量的氯气泄漏时,应用浸有弱碱性溶液的毛巾捂住口鼻向高处跑.
| A、①② | B、①③ | C、②④ | D、③④ |
下列说法不正确的是( )
| A、分子式为C3H8与C6H14的两种有机物一定互为同系物 |
| B、对有机物分子红外光谱图的研究有助于确定有机物分子中的基团 |
| C、分子式C4H10表示的物质必是纯净物 |
D、有机物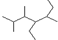 的名称:2,3,5-三甲基-4-乙基庚烷 的名称:2,3,5-三甲基-4-乙基庚烷 |
下列有关电解质溶液中微粒浓度关系正确的是( )
| A、pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) |
| B、含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) |
| C、0.1 mol/L NH4Cl与0.1 mol/L氨水等体积混合(pH>7):c(NH3?H2O)>c(NH4+)>c(Cl-)>c(OH-) |
| D、含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
下列表示对应化学反应的离子方程式正确的是( )
| A、NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
| B、向40 mL 8 mol/L的稀硝酸溶液中加入5.6 g铁粉:Fe+4H++NO3-=Fe3++NO↑+2H2O |
| C、用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O |
| D、FeI2溶液中通入过量Cl2:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
 (1)将下列离子Na+、K+、Cu2+、H+、NO3-、Cl-、CO32-、OH-,按可能大量共存于同一溶液的情况,则分成A、B两组,而且每组中均含两种阳离子和两种阴离子,则A组
(1)将下列离子Na+、K+、Cu2+、H+、NO3-、Cl-、CO32-、OH-,按可能大量共存于同一溶液的情况,则分成A、B两组,而且每组中均含两种阳离子和两种阴离子,则A组