题目内容
(1)下列物质中属于电解质的是 ,能导电的是
①铜 ②酒精 ③氨气 ④盐酸 ⑤熔融的KCl晶体 ⑥硫酸钡
(2)1mol SO2的质量为 ,含有的质子数为
(3)在反应2H2S+SO2=3S↓+2H2O中,氧化产物与还原产物的物质的量之比为
(4)常温常压下,7g乙烯(C2H4)和丙烯(C3H6)的混合物中含有的氢原子数目为 .
①铜 ②酒精 ③氨气 ④盐酸 ⑤熔融的KCl晶体 ⑥硫酸钡
(2)1mol SO2的质量为
(3)在反应2H2S+SO2=3S↓+2H2O中,氧化产物与还原产物的物质的量之比为
(4)常温常压下,7g乙烯(C2H4)和丙烯(C3H6)的混合物中含有的氢原子数目为
考点:电解质与非电解质,物质分子中的原子个数计算,氧化还原反应
专题:
分析:(1)水溶液中或熔融状态下能够导电的化合物称为电解质,酸、碱、盐都是电解质;在上述两种情况下都不能导电的化合物称为非电解质,蔗糖、乙醇等都是非电解质.大多数的有机物都是非电解质;单质,混合物既不是电解质也不是非电解质;物质导电有两种原因,一是金属类有自由移动的电子能够导电,二是能够产生自由离子的溶液能够导电;
(2)依据m=n×M计算即可;O含有质子数为8,S为16,据此计算即可;
(3)依据还原剂发生氧化反应得到氧化产物,氧化剂发生还原反应得到还原产物计算即可;
(4)乙烯和丙烯的最简式为CH2,根据最简式计算出混合物中含有的氢原子数目.
(2)依据m=n×M计算即可;O含有质子数为8,S为16,据此计算即可;
(3)依据还原剂发生氧化反应得到氧化产物,氧化剂发生还原反应得到还原产物计算即可;
(4)乙烯和丙烯的最简式为CH2,根据最简式计算出混合物中含有的氢原子数目.
解答:
解:(1)①铜属于单质,既不是电解质也不是非电解质,能导电;
②酒精不能导电,属于非电解质;
③氨气不能导电,属于非电解质;
④盐酸能导电,属于混合物,既不是电解质也不是非电解质;
⑤熔融的KCl晶体能导电,属于电解质;
⑥硫酸钡不能导电,熔融状态下能导电,属于电解质,故答案为:⑤⑥;①④⑤;
(2)m=n×M=1mol×64g/mol=64g,1molSO2的中含有的质子数为:8×2+16=32,故答案为:64g;32NA;
(3)该反应中,硫化氢作还原剂,氧化产物为S,二氧化硫作氧化剂,还原产物为S,由于硫化氢与二氧化硫的物质的量之比为2:1,故氧化产物与还原产物的物质的量之比也为2:1,故答案为:2:1;
(4)7.0g乙烯与丙烯的混合物中含有0.5mol最简式CH2,含有1mol氢原子,含有氢原子的数目为NA,故答案为:NA.
②酒精不能导电,属于非电解质;
③氨气不能导电,属于非电解质;
④盐酸能导电,属于混合物,既不是电解质也不是非电解质;
⑤熔融的KCl晶体能导电,属于电解质;
⑥硫酸钡不能导电,熔融状态下能导电,属于电解质,故答案为:⑤⑥;①④⑤;
(2)m=n×M=1mol×64g/mol=64g,1molSO2的中含有的质子数为:8×2+16=32,故答案为:64g;32NA;
(3)该反应中,硫化氢作还原剂,氧化产物为S,二氧化硫作氧化剂,还原产物为S,由于硫化氢与二氧化硫的物质的量之比为2:1,故氧化产物与还原产物的物质的量之比也为2:1,故答案为:2:1;
(4)7.0g乙烯与丙烯的混合物中含有0.5mol最简式CH2,含有1mol氢原子,含有氢原子的数目为NA,故答案为:NA.
点评:本题较简单,主要考查电解质的定义、有关物质的量的计算等,难度不大,熟悉常见的酸、碱、盐都属于电解质来解答,注意导电,要从导电实质的角度去分析给定物质是否具备导电性能.

练习册系列答案
相关题目
下列有关电解质溶液中微粒浓度关系正确的是( )
| A、pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) |
| B、含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) |
| C、0.1 mol/L NH4Cl与0.1 mol/L氨水等体积混合(pH>7):c(NH3?H2O)>c(NH4+)>c(Cl-)>c(OH-) |
| D、含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
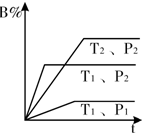 已知某可逆反应mA(g)+n B(g)?pC(g)△Η=Q在密闭容器中进行,如图中表示在不同反应时间t时,温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析下列判断正确的( )
已知某可逆反应mA(g)+n B(g)?pC(g)△Η=Q在密闭容器中进行,如图中表示在不同反应时间t时,温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析下列判断正确的( )| A、T1<T2 P1>P2 m+n>p Q<0 |
| B、T1>T2 P1<P2 m+n>p Q<0 |
| C、T1<T2 P1>P2 m+n<p Q>0 |
| D、T1>T2 P1<P2 m+n<p Q>0 |
下列叙述不正确的是( )
| A、0.1 mol?L-1NaOH溶液与0.2 mol?L-1CH3COOH溶液等体积混合后:c(CH3COOH)+c(CH3COO-)=0.2 mol?L-1 |
| B、常温下,将CH3COONa和HCl两溶液混合呈中性的溶液中:c(Na+)>c(Cl-)=c(CH3COOH) |
| C、pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4溶液,c(NH4+)大小顺序为①=②>③ |
| D、25℃时,pH=a的盐酸与pH=b的Ba(OH)2溶液等体积混合后,恰好完全反应,则a+b=14 |