题目内容
根据你的观察和积累的知识,试填写:
(1)下列反应中属于放热反应的是 属于吸热反应的是 .
①煅烧石灰石 ②木炭燃烧 ③炸药爆炸 ④酸碱中和 ⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
(2)下列物质中①Ar ②CO2③SiO2④NaOH ⑤K2S,只存在共价键的是 ;只存在离子键的是 ;既存在共价键又存在离子键的是 ;不存在化学键的是 .
(3)写出下列物质的电子式:Na2O2: CO2:
(4)用电子式写出下列物质的形成过程:HCl: CaBr2: .
(1)下列反应中属于放热反应的是
①煅烧石灰石 ②木炭燃烧 ③炸药爆炸 ④酸碱中和 ⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
(2)下列物质中①Ar ②CO2③SiO2④NaOH ⑤K2S,只存在共价键的是
(3)写出下列物质的电子式:Na2O2:
(4)用电子式写出下列物质的形成过程:HCl:
考点:吸热反应和放热反应,离子化合物的结构特征与性质,共价键的形成及共价键的主要类型,用电子式表示简单的离子化合物和共价化合物的形成
专题:化学反应中的能量变化,化学键与晶体结构
分析:(1)根据常见的放热反应和吸热反应来判断;
(2)化学键是构成物质的重要方式之一,特殊的物质不存在任何化学键,如Ar等单原子分子;离子化合物中可能含有共价键,共价化合物中一定不含离子键;
(3)首先判断化合物是离子化合物还是共价化合物;依据电子式的书写写出,即把原子的最外层电子表示出来;
若是离子化合物,其电子式由阴、阳离子的电子式组合而成,相同的离子不能合并;
若是共价化合物,其电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况;
(4)根据电子式的书写方法以及物质含有的化学键知识来回答.
(2)化学键是构成物质的重要方式之一,特殊的物质不存在任何化学键,如Ar等单原子分子;离子化合物中可能含有共价键,共价化合物中一定不含离子键;
(3)首先判断化合物是离子化合物还是共价化合物;依据电子式的书写写出,即把原子的最外层电子表示出来;
若是离子化合物,其电子式由阴、阳离子的电子式组合而成,相同的离子不能合并;
若是共价化合物,其电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况;
(4)根据电子式的书写方法以及物质含有的化学键知识来回答.
解答:
解:(1)因常见的放热反应有:所有的燃烧、所有的中和反应、金属和酸的反应、金属与水的反应、大多数化合反应、铝热反应等,所以放热反应有:②③④⑤⑥;常见的吸热反应为:大多数的分解反应,氢氧化钡和氯化铵的反应、焦炭和二氧化碳、焦炭和水的反应等,所以吸热反应有①,
故答案为:②③④⑤⑥;①;
(2)CO2和SiO2中,C和O、Si和O都是以共价键相结合,故只存在共价键的是②③;
K2S中,K+与S2-以离子键相结合,故只存在离子键的是⑤;
NaOH中,Na+与OH-以离子键相结合,O与H之间是共价键,故既存在共价键又存在离子键的是④;
Ar是单原子分子,不存在任何化学键,故不存在化学键的是①,
故答案为:②③;⑤;④;①;
(3)Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为 ,CO2是共价化合物,碳原子有四个电子分别和氧原子形成两对共用电子对,电子式为
,CO2是共价化合物,碳原子有四个电子分别和氧原子形成两对共用电子对,电子式为 ,
,
故答案为: ;
; ;
;
(4)HCl是氢原子和氯原子通过共价键形成的极性分子,其形成过程是:H?+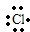 →
→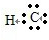 ,CaBr2是离子化合物,形成过程为:
,CaBr2是离子化合物,形成过程为:
 +?Mg?+
+?Mg?+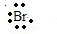 →
→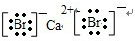 ;
;
故答案为:H?+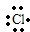 →
→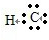 ;
; +?Mg?+
+?Mg?+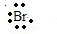 →
→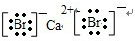 .
.
故答案为:②③④⑤⑥;①;
(2)CO2和SiO2中,C和O、Si和O都是以共价键相结合,故只存在共价键的是②③;
K2S中,K+与S2-以离子键相结合,故只存在离子键的是⑤;
NaOH中,Na+与OH-以离子键相结合,O与H之间是共价键,故既存在共价键又存在离子键的是④;
Ar是单原子分子,不存在任何化学键,故不存在化学键的是①,
故答案为:②③;⑤;④;①;
(3)Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为
 ,CO2是共价化合物,碳原子有四个电子分别和氧原子形成两对共用电子对,电子式为
,CO2是共价化合物,碳原子有四个电子分别和氧原子形成两对共用电子对,电子式为 ,
,故答案为:
 ;
; ;
;(4)HCl是氢原子和氯原子通过共价键形成的极性分子,其形成过程是:H?+
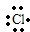 →
→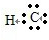 ,CaBr2是离子化合物,形成过程为:
,CaBr2是离子化合物,形成过程为: +?Mg?+
+?Mg?+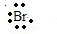 →
→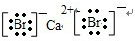 ;
;故答案为:H?+
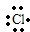 →
→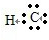 ;
; +?Mg?+
+?Mg?+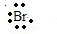 →
→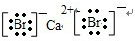 .
.
点评:本题考查了反应类型的判断、化学键的类型判断、电子式的书写.注意稀有气体中无化学键,共价化合物的电子式不能出现电荷和中括号.

练习册系列答案
相关题目
 将镉(Cd)浸在氯化钴(CoCl2)溶液中,发生反应的离子方程式为:Co2+(aq)+Cd(s)=Co(s)+Cd2+(aq)(aq表示溶液),如将该反应设计为如右图的原电池,则下列说法一定错误的是( )
将镉(Cd)浸在氯化钴(CoCl2)溶液中,发生反应的离子方程式为:Co2+(aq)+Cd(s)=Co(s)+Cd2+(aq)(aq表示溶液),如将该反应设计为如右图的原电池,则下列说法一定错误的是( )| A、Cd作负极,Co作正极 |
| B、原电池工作时,电子从负极沿导线流向正极 |
| C、根据阴阳相吸原理,盐桥中的阳离子向负极(甲池)移 动 |
| D、甲池中盛放的是CdCl2溶液,乙池中盛放的是CoCl2溶液 |
一定量的10%的NaOH溶液,若将其蒸发掉100g水后,其质量分数为20%,体积为100mL,则浓缩后的NaOH的物质的量浓度为( )
| A、2.2mol/L |
| B、4mol/L |
| C、5mol/L |
| D、6.25mol/L |
用NA表示阿伏加德罗常数的值.下列说法正确是( )
| A、标准状况下,2.24L二氧化碳中含有共用电子对的数目为0.2NA |
| B、25℃时,pH=12的Na2CO3溶液中含有OH-的数目为0.01NA |
| C、常温常压下,28g乙烯和丙烯的混合气体中含有碳原子的数目为2NA |
| D、0.1mol Cl2与足量铁粉反应转移电子的数目为0.3NA |




