题目内容
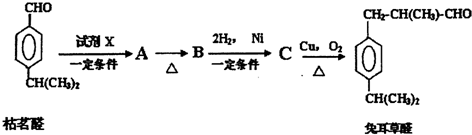
难溶性杂卤石(K2SO4?MgSO4?2CaSO4?2H2O)属于“呆矿”,在水中存在如下平衡K2SO4?MgSO4?2CaSO4?2H2O (s)?2Ca2++2K++Mg2++4SO42-+2H2O为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如图1:

(1)滤渣主要成分有 和 以及未溶杂卤石.
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因: .
(3)“除杂”环节中,先加入 溶液,经搅拌等操作后,过滤,再加入 溶液调滤液pH至中性.
(4)过滤得到的母液中含有大量的 (填写化学式),溶液中离子浓度大小顺序为 ,检验其中溶质阴离子的方法是 .
(5)不同温度下,K+的浸出浓度与溶浸时间的关系如图2,由图可得,随着温度升高
① ;
② .

(1)滤渣主要成分有
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:
(3)“除杂”环节中,先加入
(4)过滤得到的母液中含有大量的
(5)不同温度下,K+的浸出浓度与溶浸时间的关系如图2,由图可得,随着温度升高
①
②
考点:物质分离和提纯的方法和基本操作综合应用,难溶电解质的溶解平衡及沉淀转化的本质
专题:实验设计题
分析:(1)依据流程和制取目的,结合杂卤石在水中存在的平衡分析,加入饱和Ca(OH)2溶液对平衡的影响分析判断;
(2)依据氢氧化钙和平衡状态下的镁离子结合生成氢氧化镁沉淀,促进平衡右移分析;
(3))“除杂”环节中主要是除去钙离子,但不能引入新的杂质,调节溶液PH呈中性,除去加入的碳酸钾,得到较纯净的硫酸钾,需要加入硫酸调节;
(4)过滤得到的母液中含有大量的 K2SO4;因为K2SO4=2K++SO42-,溶液呈中性,则可推出溶液中离子浓度大小顺序,根据硫酸根离子的检验方法回答;
(5)依据图象分析,纵轴意义,曲线的变化,达到平衡需要的时间分析判断.
(2)依据氢氧化钙和平衡状态下的镁离子结合生成氢氧化镁沉淀,促进平衡右移分析;
(3))“除杂”环节中主要是除去钙离子,但不能引入新的杂质,调节溶液PH呈中性,除去加入的碳酸钾,得到较纯净的硫酸钾,需要加入硫酸调节;
(4)过滤得到的母液中含有大量的 K2SO4;因为K2SO4=2K++SO42-,溶液呈中性,则可推出溶液中离子浓度大小顺序,根据硫酸根离子的检验方法回答;
(5)依据图象分析,纵轴意义,曲线的变化,达到平衡需要的时间分析判断.
解答:
解:(1)杂卤石在水中存在沉淀溶解平衡:K2SO4?MgSO4?2CaSO4?2H2O(s)?2Ca2++2K++Mg2++4SO42-+2H2O,为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,氢氧根离子和镁离子结合生成氢氧化镁沉淀,同时钙离子增多,析出硫酸钙沉淀,所以滤渣中主要成分为CaSO4,Mg(OH)2,
故答案为:CaSO4;Mg(OH)2;
(2)Ca(OH)2溶液能溶解杂卤石浸出K+的原因是氢氧化钙是饱和溶液,加入后氢氧根离子和镁离子结合生成氢氧化镁沉淀,促进平衡右移钙离子增多,饱和溶液中析出氢氧化钙,增多K+,故答案为:氢氧根与镁离子结合使平衡向右移动,钾离子变多;
(3))“除杂”环节主要是除去钙离子,依据除杂原则不能引入新的杂质,根据制取的目的是制备硫酸钾,所以加入的试剂易于除去,不引入新的杂质,因此加入过量K2CO3除钙离子,过滤后加入硫酸至中性,除去碳酸钾,故答案为:K2CO3;H2SO4;
(4)过滤得到的母液中含有大量的 K2SO4;因为K2SO4=2K++SO42-,溶液呈中性,则溶液中离子浓度大小顺序为 c(K+)>c(SO42-)>c(H+)=c(OH-),检验其中溶质阴离子硫酸根离子的方法是:取样,先加足量盐酸酸化,再加入氯化钡溶液,看是有产生白色沉淀,
故答案为:K2SO4,c(K+)>c(SO42-)>c(H+)=c(OH-);取样,先加足量盐酸酸化,再加入氯化钡溶液,看是有产生白色沉淀;
(5)分析不同温度下,K+的浸出浓度与溶浸时间的关系,温度越高K+的浸出浓度越大,溶浸时间越短,反应速率越大,达到平衡越快,故图象中分析得到的结论为:温度越高,在同一时间K+的浸出浓度大;反应速率加快,平衡时溶浸时间短,
故答案为:在同一时间K+的浸出浓度大;反应速率加快,平衡时溶浸时间短.
故答案为:CaSO4;Mg(OH)2;
(2)Ca(OH)2溶液能溶解杂卤石浸出K+的原因是氢氧化钙是饱和溶液,加入后氢氧根离子和镁离子结合生成氢氧化镁沉淀,促进平衡右移钙离子增多,饱和溶液中析出氢氧化钙,增多K+,故答案为:氢氧根与镁离子结合使平衡向右移动,钾离子变多;
(3))“除杂”环节主要是除去钙离子,依据除杂原则不能引入新的杂质,根据制取的目的是制备硫酸钾,所以加入的试剂易于除去,不引入新的杂质,因此加入过量K2CO3除钙离子,过滤后加入硫酸至中性,除去碳酸钾,故答案为:K2CO3;H2SO4;
(4)过滤得到的母液中含有大量的 K2SO4;因为K2SO4=2K++SO42-,溶液呈中性,则溶液中离子浓度大小顺序为 c(K+)>c(SO42-)>c(H+)=c(OH-),检验其中溶质阴离子硫酸根离子的方法是:取样,先加足量盐酸酸化,再加入氯化钡溶液,看是有产生白色沉淀,
故答案为:K2SO4,c(K+)>c(SO42-)>c(H+)=c(OH-);取样,先加足量盐酸酸化,再加入氯化钡溶液,看是有产生白色沉淀;
(5)分析不同温度下,K+的浸出浓度与溶浸时间的关系,温度越高K+的浸出浓度越大,溶浸时间越短,反应速率越大,达到平衡越快,故图象中分析得到的结论为:温度越高,在同一时间K+的浸出浓度大;反应速率加快,平衡时溶浸时间短,
故答案为:在同一时间K+的浸出浓度大;反应速率加快,平衡时溶浸时间短.
点评:本题考查了沉淀溶解平衡的影响因素分析判断,流程分析,分离提纯的方法应用,图象分析判断方法,平衡常数的计算应用,溶度积的计算分析,沉淀转化的判断,题目难度中等.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
下列关于常温下电解质溶液的叙述中,正确的是( )
| A、碳酸氢铵溶液和足量氢氧化钠溶液混合,反应的离子方程式为:HCO3-+OH-═CO32-+H2O |
| B、25℃时,pH=8的0.1mol?L-1NaX溶液中由水电离出的c(OH-)=1×10-8mol?L-1 |
| C、等物质的量浓度的NH4Cl溶液和NH3?H2O溶液中,c(NH4+)前者小于后者 |
| D、等物质的量浓度、等体积的氨水和盐酸混合后,c(H+)+c(NH4+)=c(Cl-)+c(OH-) |
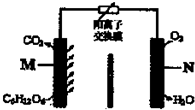 一种新型污水处理装置如图所示.该装置可利用一种微生物将有机废水的化学能直接转化为电能.下列说法中不正确的是( )
一种新型污水处理装置如图所示.该装置可利用一种微生物将有机废水的化学能直接转化为电能.下列说法中不正确的是( )| A、电池工作时H+从M极区移向N极区 |
| B、N极为正极,发生还原反应 |
| C、M极的电极反应式为:C6H12O6+6H2O-24e-═6CO2↑+24H+ |
| D、当N极消耗5.6L(标况下)气体时,则有2NA个H+通过离子交换膜 |



 X、Y、Z均是由两种短周期元素组成的无机物,它们的每个分子中均含有l8个电子,相关信息如下表所示(“/”表示相应的信息略去):
X、Y、Z均是由两种短周期元素组成的无机物,它们的每个分子中均含有l8个电子,相关信息如下表所示(“/”表示相应的信息略去): ,则X的化学式为
,则X的化学式为