题目内容
一定量的10%的NaOH溶液,若将其蒸发掉100g水后,其质量分数为20%,体积为100mL,则浓缩后的NaOH的物质的量浓度为( )
| A、2.2mol/L |
| B、4mol/L |
| C、5mol/L |
| D、6.25mol/L |
考点:物质的量浓度的相关计算
专题:
分析:根据蒸发前后溶质的质量不变来计算溶质的质量,利用n=
、c=
来计算浓缩后的NaOH的物质的量浓度.
| m |
| M |
| n |
| V |
解答:
解:设原NaOH溶液的质量为x,则
x×10%=(x-100)×20%,
解得x=200g,
NaOH的质量为200g×10%=20g,
则n=
=0.5mol,
所以浓缩后的NaOH的物质的量浓度为
=5mol/L,
故选C.
x×10%=(x-100)×20%,
解得x=200g,
NaOH的质量为200g×10%=20g,
则n=
| 20g |
| 40g/mol |
所以浓缩后的NaOH的物质的量浓度为
| 0.5mol |
| 0.1L |
故选C.
点评:本题考查物质的量浓度的有关计算,明确稀释前后的溶质质量不变及以物质的量为中心的计算即可解答,难度不大.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A、28g乙烯所含共用电子对数目为4NA |
| B、0.5mol 1,3-丁二烯分子中含有C=C双键数为NA |
| C、1 mol羟基所含的电子总数为10NA |
| D、标准状况下,11.2 L己烷所含分子数为0.5NA |
绿色化学己成为当前化学研究的热点和前沿,旨在从源头上消除污染,实现经济和社会可持续发展.而常温离子液体(ionic liquid)(也称常温熔融盐)以其优异的理化特性最有可能使上述理想变为现实.1914年报道的第一种离子液体硝酸乙基铵〔(C2H5NH3)NO3〕离子液体其熔点为12℃.已知C2H5NH2结合质子的能力比NH3略强,下列有关硝酸乙基铵的说法正确的是( )
| A、离子液体可以作为电池的电解质 |
| B、硝酸乙基铵水溶液呈碱性 |
| C、硝酸乙基铵水解的离子方程式表示为:C2H5NH3++H2O═C2H5NH2+H3O+ |
| D、相同温度下,相同物质的量浓度的硝酸乙基铵溶液和硝酸铵溶液前者的pH值小 |
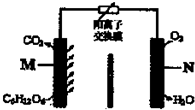 一种新型污水处理装置如图所示.该装置可利用一种微生物将有机废水的化学能直接转化为电能.下列说法中不正确的是( )
一种新型污水处理装置如图所示.该装置可利用一种微生物将有机废水的化学能直接转化为电能.下列说法中不正确的是( )| A、电池工作时H+从M极区移向N极区 |
| B、N极为正极,发生还原反应 |
| C、M极的电极反应式为:C6H12O6+6H2O-24e-═6CO2↑+24H+ |
| D、当N极消耗5.6L(标况下)气体时,则有2NA个H+通过离子交换膜 |
R、X、Y、M、Z五种短周期主族元素的原子半径依次减小,X、Y、Z的电子层数之和为5,X元素原子的最外层电子数是它的电子层数的2倍,Y元素原子的最外层电子数是X和Z两元素原子最外层电子数的总和,M是地壳中含量最多的元素,R与Z的最外层电子数相同下列叙述正确的是( )
| A、Z与M形成的化合物中不可能含有非极性键 |
| B、对应氢化物的热稳定性:X>Y>M |
| C、单质的还原性:R>M>Y>X |
| D、X、Y、M、Z四种元素组成的离子化合物受热易分解 |