题目内容
2.聚合铝(PAC)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理.用铝灰、铝土矿、铝渣等为原料(主要成分为Al、Al2O3)可制取聚合铝.实验步骤如下: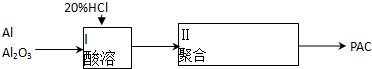
写出铝、氧化铝分别与盐酸反应的离子方程式:2Al+6H+=2Al3++3H2↑,Al2O3+6H+=2Al3++3H2O.
分析 金属铝与盐酸反应生成氯化铝和氢气,反应实质为铝与氢离子反应生成铝离子和氢气;氧化铝为碱性氧化物,与盐酸反应生成氯化铝和水,反应实质为氧化铝与氢离子反应生成铝离子和水,据此写出反应的离子方程式.
解答 解:铝与盐酸反应生成氯化铝和氢气,反应的离子方程式为:2Al+6H+=2Al3++3H2↑;
氧化铝为难溶物,能够与盐酸反应生成氯化铝和水,反应的离子方程式为:Al2O3+6H+=2Al3++3H2O,
故答案为:2Al+6H+=2Al3++3H2↑;Al2O3+6H+=2Al3++3H2O.
点评 本题考查了离子方程式的书写,题目难度不大,明确离子方程式的书写原则为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
13.把Fe粉、Cu粉置于FeCl3溶液中,充分反应后加入KSCN不显红色,下列情况不能成立的是( )
| A. | 铁不剩余,Cu剩余 | B. | 铜不剩余、铁剩余 | C. | 铁、铜均剩余 | D. | 铁、铜均不剩余 |
17.10gNaOH溶解于90g水中,溶液内含有H元素的物质的量是( )
| A. | 0.25mol | B. | 10.25mol | C. | 10mol | D. | 0.5mol |
7.下列各组元素中,按微粒半径递增顺序排列的是( )
| A. | Li、Na、K | B. | Ba2+、Ca2+、Mg2+ | C. | K+、Ca2+、Cl- | D. | N、O、F |
14.体积不变的密闭容器中进行如下反应:X2(g)+3Y2(g)?2Z(g),X2、Y2、Z起始浓度分别为0.4mol•L-1、0.6mol•L-1、0.4mol•L-1,当平衡时,下列数据肯定不对的是( )
| A. | X2为0.5mol•L-1,Y2为1.0mol•L-1 | B. | Y2为1.0mol•L-1 | ||
| C. | X2为0.5mol•L-1,Z为0.2mol•L-1 | D. | Z为0.6mol•L-1 |
11.2015年12月全球气候大会达成约定要节能减排.下列措施中,不利于节能减排和改善环境的是 ( )
| A. | 推广可利用太阳能、风能的城市照明系统 | |
| B. | 使用露天焚烧法处理未经分类的生活垃圾 | |
| C. | 加速建设地铁、轻轨等轨道交通,减少汽车尾气排放 | |
| D. | 积极推行“限塑令”,加快研发利用二氧化碳合成的聚碳酸酯类可降解塑料 |
12.当线型高分子链上如果还有能起反应的官能团时,在一定条件下就会形成体型高分子结构.下列有机物在一定条件下通过反应最终可能得到体型结构的高分子化合物的是( )
| A. | CH2=CH2 | B. | CH3COOH | C. | CH2=CHClC=CH2 | D. | CH2=CHCH2OH |