题目内容
10.(1)某温度下,纯水的c(H+)=2×10-7mol•L-1,则此时c(OH-)为2×10-7mol•L-1;若温度不变,滴入稀盐酸使c(H+)=5×10-4mol•L-1则溶液中由水电离产生的c(H+)为8×10-11mol/L,此时温度高于(填“高于”、“低于”或“等于”)25℃.(2)已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
①C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H2=-242.0kJ/mol
③CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H3=-283.0kJ/mol
写出C(s)与水蒸气反应生成CO和H2的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.5KJ/mol.
(3)常温下,取物质的量浓度相同的NaOH和HCl溶液,以3:2体积比相混合,所得混合液的pH=12,则原溶液的物质的量浓度为0.05mol/L.(溶液体积变化忽略不计)
(4)常温下,0.lmol•L-1NaHCO3溶液的pH大于7,用离子方程式表示其原因HCO3-+H2O?H2CO3+OH-.
(5)常温下0.1mol/L的下列溶液①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4溶液中c(NH4+)由大到小的顺序是:①>②>④>③.(填序号)
分析 (1)纯水中c(H+)=c(OH-),Kw=c(H+)×c(OH-),水的离子积常数只与温度有关,与溶液的酸碱性无关,酸性溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度,水的电离是吸热反应,升高温度能促进水电离,所以温度越高,水的离子积常数越大,据此分析解答;
(2)依据热化学方程式和盖斯定律计算①-②-③得到所需热化学方程式;
(3)酸碱混合后,pH=12,则碱过量,剩余的c(OH-)=0.01mol/L,以此来计算;
(4)碳酸氢钠是强酸弱碱盐,溶液中碳酸氢根离子水解程度大于电离程度,溶液显碱性;
(5)铝离子水解显酸性抑制铵根离子水解,醋酸根离子促进铵根离子水解,氯离子对铵根离子水解无影响,一水合氨是弱碱存在微弱的电离平衡,据此分析.
解答 解:(1)纯水中水电离方程式为:H2O?H++OH-,c(H+)=c(OH-)=2×10-7 mol•L-1,Kw=c(H+).c(OH-)=2×10-7×2×10-7=4×10-14,
温度不变,水的离子积常数不变,滴入稀盐酸使c(H+)=5×10-4mol•L-1,所以c(OH-)=$\frac{Kw}{c({H}^{+})}$=$\frac{4×1{0}^{-14}}{5×1{0}^{-4}}$=8×10-11mol/L,酸性溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度,所以水电离出的氢离子浓度是8×10-11mol/L,水的电离是吸热反应,升高温度能促进水电离,所以温度越高,水的离子积常数越大,该温度下的水的离子积常数是4×10-14>1×10-14,所以该温度高于25°C;
故答案为:2×10-7 mol•L-1;8×10-11mol/L;高于;
(2)①C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H2=-242.0kJ/mol
③CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H3=-283.0kJ/mol
依据盖斯定律计算①-②-③得到,C(s)与水蒸气反应生成CO和H2的热化学方程式为:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.5KJ/mol,
故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.5KJ/mol;
(3)设NaOH和HCl的物质的量浓度均为x,NaOH和HCl溶液以3:2体积比相混合,体积分别为3V、2V,
酸碱混合后,pH=12,则碱过量,剩余的c(OH-)=0.01mol/L,
则$\frac{3V×x-2V×x}{5V}$=0.01mol/L,
解得x=0.05mol/L,
故答案为:0.05mol/L;
(4)NaHCO3溶液的pH大于7,是因为HCO3-水解,反应离子方程式为:HCO3-+H2O?H2CO3+OH-,溶液呈碱性,故答案为:HCO3-+H2O?H2CO3+OH-;
(5)①NH4Al(SO4)2 中铝离子水解溶液显酸性,Al3++3H2O?Al(OH)3+3H+,抑制铵根离子水解;
②NH4Cl是强酸弱碱盐,铵根离子能水解但较弱;
③NH3•H2O是弱电解质,电离程度较小;
④CH3COONH4中醋酸根离子促进铵根离子水解,
水解是微弱的反应过程,水解程度很小,所以铵根离子浓度大小顺序是:①>②>④>③,
故答案为:①>②>④>③;
点评 本题考查了水的离子积常数、热化学方程式和盖斯定律、酸碱混合的计算、盐类水解及离子浓度大小的比较,注意水的离子积常数只与温度有关,与溶液的酸碱性无关,盐类水解程度微弱和影响因素判断,题目难度中等.

| A. | Mg2+、Fe3+、NO3-、K+ | B. | Al3+、Na+、Cl-、SO42- | ||
| C. | Na+、Ba2+、NO3-、Cl- | D. | K+、Na+、Cl-、HCO3- |
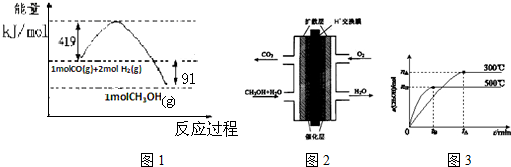
已知①常压下反应的能量变化如图1所示:
②有关键能的数据
| 化学键 | H-H | H-O | O=O |
| 键能KJ/mol | 436 | x | 496 |
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-284 kJ/mol
H2O(l)═H2O(g)△H=+44kJ/mol
请回答下列问题
(1)请写出表示气态甲醇燃烧热的热化学方程式CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-757kJ•mol-1
(2)在低温情况下有利于一氧化碳和氢气制备甲醇的反应自发进行(填“高温”或“低温”),H-O的键能数据x的值为462
(3)甲醇燃料电池的结构示意图如图2.甲醇进入负极极(填“正”或“负”),正极发生的电极反应为O2+4e-+4H+=2H2O.
Ⅱ.一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.
(4)该反应的平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;根据图3,升高温度,K值将减小(填“增大”、“减小”或“不变”).
(5)判断该可逆反应达到化学平衡状态的标志是cdf(填字母).
a.v生成(CH3OH)=v消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度均不再变化.
| A. | 将盐卤或石膏加入豆浆中制豆腐 | |
| B. | 钢笔同时使用两种不同牌号的蓝黑墨水,易出现堵塞 | |
| C. | 向氯化铁溶液中加入氢氧化钠溶液出现红褐色沉淀 | |
| D. | 在河水与海水的交界处,易形成三角洲 |
| A. | 乙烯的最简式:CH2=CH2; 对甲基苯甲醇的结构简式: | |
| B. | Cl-的结构示意图: 甲烷分子的球棍模型: 甲烷分子的球棍模型: | |
| C. | HCO3-的水解方程式为:HCO3-+H2O?CO32-+H3O+ | |
| D. | 羟基的电子式: 原子核内有20个中子的氯原子:${\;}_{17}^{37}$Cl 原子核内有20个中子的氯原子:${\;}_{17}^{37}$Cl |