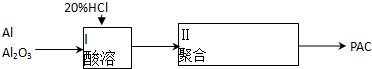
题目内容
14.体积不变的密闭容器中进行如下反应:X2(g)+3Y2(g)?2Z(g),X2、Y2、Z起始浓度分别为0.4mol•L-1、0.6mol•L-1、0.4mol•L-1,当平衡时,下列数据肯定不对的是( )| A. | X2为0.5mol•L-1,Y2为1.0mol•L-1 | B. | Y2为1.0mol•L-1 | ||
| C. | X2为0.5mol•L-1,Z为0.2mol•L-1 | D. | Z为0.6mol•L-1 |
分析 化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,
若反应向正反应进行到达平衡,X2、Y2的浓度最小,Z的浓度最大,假定完全反应,则:
根据方程式 X2(气)+3Y2(气)?2Z(气),
开始(mol/L):0.4 0.6 0.4
变化(mol/L):0.2 0.6 0.4
平衡(mol/L):0.2 0 0.8
若反应逆正反应进行到达平衡,X2、Y2的浓度最大,Z的浓度最小,假定完全反应,则:
根据方程式 X2(气)+3Y2(气)?2Z(气),
开始(mol/L):0.4 0.6 0.4
变化(mol/L):0.2 0.6 0.4
平衡(mol/L):0.6 1.2 0
据此判断分析.
解答 解:若反应向正反应进行到达平衡,X2、Y2的浓度最小,Z的浓度最大,假定完全反应,则:
根据方程式 X2(气)+3Y2(气)?2Z(气),
开始(mol/L):0.4 0.6 0.4
变化(mol/L):0.2 0.6 0.4
平衡(mol/L):0.2 0 0.8
若反应逆正反应进行到达平衡,X2、Y2的浓度最大,Z的浓度最小,假定完全反应,则:
根据方程式 X2(气)+3Y2(气)?2Z(气),
开始(mol/L):0.4 0.6 0.4
变化(mol/L):0.2 0.6 0.4
平衡(mol/L):0.6 1.2 0
由于为可能反应,物质不能完全转化所以平衡时浓度范围为0.2<c(X2)<0.6,0<c(Y2)<1.2,0<c(Z)<0.8
同时由反应可知,当反应物减少时生成物一定增加,当反应物增加时生成物一定减少,反应物和生成物不能同时增加或减少,
A.X2为0.5mol•L-1,反应逆向进行,计算可知Y2为0.9mol•L-1,故A错误;
B.分析可知0<c(Y2)<1.2,可以Y2为1.0mol•L-1,故B正确;
C.X2为0.5mol•L-1,反应逆向进行,消耗Z为0.2mol/L,生成X2为0.1mol/L,最后Z为0.4mol/L-0.2mol•L-1=0.2mol•L-1,故C正确;
D.上述分析可知,0<c(Z)<0.8,Z可以为0.6mol•L-1 ,故D正确;
故选A.
点评 本题考查了化学平衡的建立,难度中等,关键是利用可逆反应的不完全性,运用极限假设法解答,假设法是解化学习题的常用方法.

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案| A. | 容器内只含有18O2、SO2、SO3三种分子 | |
| B. | 18O只存在18O2分子中 | |
| C. | 容器内含有18O2、S18O2、S18O3等分子 | |
| D. | 反应达到限度时,容器内只含有18O2、S18O2、S18O3分子 |
| A. | 将盐卤或石膏加入豆浆中制豆腐 | |
| B. | 钢笔同时使用两种不同牌号的蓝黑墨水,易出现堵塞 | |
| C. | 向氯化铁溶液中加入氢氧化钠溶液出现红褐色沉淀 | |
| D. | 在河水与海水的交界处,易形成三角洲 |

根据以上信息回答下列问题:
(1)该生产过程还可以与氯碱工业、硫酸工业生产相结合,工业生产硫酸的方法名称是接触室,现代氯碱工业的装置名称是离子交换膜电解槽;
(2)写出生产过程中XFe YHCl (填化学式)
(3)写出产生CuCl的化学方程式CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4
(4)生产中为了提髙CuCl产品的质量,采用抽滤或者减压过滤_法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是减少产品CuCl的损失,生产过程中调节溶液的pH不能过大的原因是防止CuCl水解.
(5)在CuCl的生成过程中理论上不需要补充S02气体,其理由是Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1:1,CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2 H2SO4反应中消耗CuSO4和SO2也为1﹕1,所以理论上不需要补充SO2气体
(6)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是防止CuCl的氧化和见光分解
(7)工业氯化亚铜的定量分析:
①称取样品0.25g(称准至0.0002g)置于预先放人玻璃珠50粒和10mL过量的FeCl3溶液 250mL锥形瓶中,不断摇动;
②待样品溶解后加水50ml,邻菲罗啉指示剂2滴;
③立即用0.10mol L-1硫酸铈标准溶液滴至绿色出现为终点;同时做空白试验一次.已知:CuCl+FeCl3═CuCl2+FeCl2 Fe2++Ce4+═Fe3++Ce3+如此再重复二次测得
| 1 | 2 | 3 | |
| 空白实验消耗硫酸铈标准溶液的体积(mL) | 0.75 | 0.50 | 0.80 |
| 0.25克样品消耗硫酸铈标准溶液的体积(mL) | 24.65 | 24.75 | 24.70 |
| A. | 锌粒与醋酸反应:Zn+2H+═Zn2++H2↑ | |
| B. | 铁粉与氯化铁溶液反应:Fe+Fe3+═2Fe2+ | |
| C. | 常温下氯气与烧碱溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
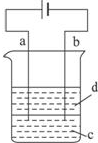 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.应用如图所示电解实验可制得白色纯净的Fe(OH)2沉淀.两电极的材料分别为石墨和铁.
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.应用如图所示电解实验可制得白色纯净的Fe(OH)2沉淀.两电极的材料分别为石墨和铁.