题目内容
7.下列各组元素中,按微粒半径递增顺序排列的是( )| A. | Li、Na、K | B. | Ba2+、Ca2+、Mg2+ | C. | K+、Ca2+、Cl- | D. | N、O、F |
分析 A.同主族自上而下原子半径增大;
B.电子层结构相同的离子,核电荷数越大离子半径越小,电子层越多离子半径越大;
C.电子层结构相同的离子,核电荷数越大离子半径越小;
D.同周期自左而右原子半径减小.
解答 解:A.同主族自上而下原子半径增大,则原子半径:Li<Na<K,故A正确;
B.电子层结构相同的离子,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:Ba2+>Ca2+>Mg2+,故B错误;
C.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:K+>Ca2+>Cl-,故C错误;
D.同周期自左而右原子半径减小,故原子半径N>O>F,故D错误,
故选:A.
点评 本题考查微粒半径大小比较,比较基础,明确微粒半径比较规律即可解答,有利于基础知识的巩固.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.下列说法正确的是( )
| A. | 弱电解质一定是共价化合物 | |
| B. | 氨气溶于水,当c(OH-)=c(NH4+)时,表明NH3•H2O电离处于平衡状态 | |
| C. | 强电解质溶液中不存在溶质分子,弱电解质溶液中存在溶质分子 | |
| D. | 由0.1 mol•L-1一元碱BOH的pH=10,可知溶液中存在BOH═B++OH- |
18.I.甲醇是重要的工业原料.煤化工可以利用煤炭制取水煤气从而合成甲醇CO(g)+2H2(g)?CH3OH(g)
已知①常压下反应的能量变化如图1所示:
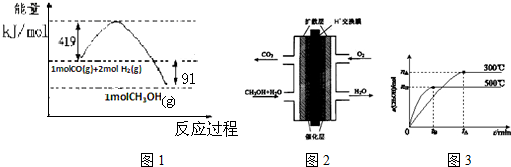
②有关键能的数据
③CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-280kJ/mol
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-284 kJ/mol
H2O(l)═H2O(g)△H=+44kJ/mol
请回答下列问题
(1)请写出表示气态甲醇燃烧热的热化学方程式CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-757kJ•mol-1
(2)在低温情况下有利于一氧化碳和氢气制备甲醇的反应自发进行(填“高温”或“低温”),H-O的键能数据x的值为462
(3)甲醇燃料电池的结构示意图如图2.甲醇进入负极极(填“正”或“负”),正极发生的电极反应为O2+4e-+4H+=2H2O.
Ⅱ.一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.
(4)该反应的平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;根据图3,升高温度,K值将减小(填“增大”、“减小”或“不变”).
(5)判断该可逆反应达到化学平衡状态的标志是cdf(填字母).
a.v生成(CH3OH)=v消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度均不再变化.
已知①常压下反应的能量变化如图1所示:

②有关键能的数据
| 化学键 | H-H | H-O | O=O |
| 键能KJ/mol | 436 | x | 496 |
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-284 kJ/mol
H2O(l)═H2O(g)△H=+44kJ/mol
请回答下列问题
(1)请写出表示气态甲醇燃烧热的热化学方程式CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-757kJ•mol-1
(2)在低温情况下有利于一氧化碳和氢气制备甲醇的反应自发进行(填“高温”或“低温”),H-O的键能数据x的值为462
(3)甲醇燃料电池的结构示意图如图2.甲醇进入负极极(填“正”或“负”),正极发生的电极反应为O2+4e-+4H+=2H2O.
Ⅱ.一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.
(4)该反应的平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;根据图3,升高温度,K值将减小(填“增大”、“减小”或“不变”).
(5)判断该可逆反应达到化学平衡状态的标志是cdf(填字母).
a.v生成(CH3OH)=v消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度均不再变化.
12.下列变化过程,属于放热反应的是( )
①液态水变成水蒸气 ②酸碱中和反应 ③浓H2SO4稀释 ④固体NaOH溶于水 ⑤H2在Cl2中燃烧 ⑥氯化铵与八水合氢氧化钡反应.
①液态水变成水蒸气 ②酸碱中和反应 ③浓H2SO4稀释 ④固体NaOH溶于水 ⑤H2在Cl2中燃烧 ⑥氯化铵与八水合氢氧化钡反应.
| A. | ①②③④⑤ | B. | ②⑤⑥ | C. | ③④⑤ | D. | ②⑤ |
19.不能用胶体有关知识解释的现象是( )
| A. | 将盐卤或石膏加入豆浆中制豆腐 | |
| B. | 钢笔同时使用两种不同牌号的蓝黑墨水,易出现堵塞 | |
| C. | 向氯化铁溶液中加入氢氧化钠溶液出现红褐色沉淀 | |
| D. | 在河水与海水的交界处,易形成三角洲 |
16.将金属A和金属B分别放入稀H2SO4中均有氢气生成.若将金属A和金属B相连后投入稀H2SO4中发现A被腐蚀;B未被腐蚀.关于B的叙述正确的是( )
| A. | 金属活动性B>A | |
| B. | 还原性B>A | |
| C. | 在后者装置中金属A发生还原反应,金属B发生氧化反应 | |
| D. | 金属B的表面上明显有气泡产生,金属A表面无气泡 |
17.金属及其化合物转化关系是化学学习的重要内容之一.下列各组物质的转化关系,不全部是通过一步反应完成的是( )
| A. | Na→NaOH→Na2CO3→NaCl | B. | Al→Al2O3→Al(OH)3→AlCl3 | ||
| C. | Mg→MgCl2→Mg(OH)2→MgSO4 | D. | Fe→FeCl2→Fe(OH)2→Fe(OH)3 |