题目内容
13.把Fe粉、Cu粉置于FeCl3溶液中,充分反应后加入KSCN不显红色,下列情况不能成立的是( )| A. | 铁不剩余,Cu剩余 | B. | 铜不剩余、铁剩余 | C. | 铁、铜均剩余 | D. | 铁、铜均不剩余 |
分析 A、铜剩余,铜能够和三价铁离子反应,溶液中不会存在Fe3+;
B、铁剩余,还原性铁大于铜;
C、铁、铜均剩余,溶液中不会存在Fe3+;
D、铁、铜恰好与FeCl3溶液反应.
解答 解:充分反应后加入KSCN不现红色,证明溶液中没有Fe3+;
A、还原性铁大于铜,铜有剩余,溶液中不会存在Fe3+,故A不选;
B、还原性铁大于铜,所以不可能铁剩余,铜不剩余,故B选;
C、铁过量,会出现铁、铜均剩余,溶液中不存在 Fe3+,故C不选;
D、铁、铜恰好与FeCl3溶液反应,溶液中也无铁离子,故D不选;
故选B.
点评 本题考查了氧化还原反应、还原性强弱的判断、三价铁离子的检验方法,综合性强,但比较容易.

练习册系列答案
相关题目
3.设为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 常温常压下,15g甲基(-CH3)所含的中子数为6NA | |
| B. | 一定条件下足量的Fe粉与浓硫酸反应,转移电子数一定为3NA | |
| C. | 在1L的碳酸钠溶液中,若c(CO32-)=1mol/L,则Na+个数为2NA | |
| D. | 含4NA个离子的固体Na2O2溶于水配成1L溶液,所得溶液中Na+的浓度为1mol/L |
1.在碱性溶液中,能大量共存的离子是( )
| A. | Mg2+、Fe3+、NO3-、K+ | B. | Al3+、Na+、Cl-、SO42- | ||
| C. | Na+、Ba2+、NO3-、Cl- | D. | K+、Na+、Cl-、HCO3- |
8.下列实验操作正确的是( )
| A. |  酸式滴定管排气泡 | B. |  配制100 mL 0.01mol/L盐酸 | ||
| C. |  测定中和热 | D. |  验证铁与水蒸气反应生成气体 |
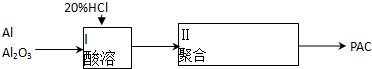
18.I.甲醇是重要的工业原料.煤化工可以利用煤炭制取水煤气从而合成甲醇CO(g)+2H2(g)?CH3OH(g)
已知①常压下反应的能量变化如图1所示:
②有关键能的数据
③CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-280kJ/mol
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-284 kJ/mol
H2O(l)═H2O(g)△H=+44kJ/mol
请回答下列问题
(1)请写出表示气态甲醇燃烧热的热化学方程式CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-757kJ•mol-1
(2)在低温情况下有利于一氧化碳和氢气制备甲醇的反应自发进行(填“高温”或“低温”),H-O的键能数据x的值为462
(3)甲醇燃料电池的结构示意图如图2.甲醇进入负极极(填“正”或“负”),正极发生的电极反应为O2+4e-+4H+=2H2O.
Ⅱ.一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.
(4)该反应的平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;根据图3,升高温度,K值将减小(填“增大”、“减小”或“不变”).
(5)判断该可逆反应达到化学平衡状态的标志是cdf(填字母).
a.v生成(CH3OH)=v消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度均不再变化.
已知①常压下反应的能量变化如图1所示:

②有关键能的数据
| 化学键 | H-H | H-O | O=O |
| 键能KJ/mol | 436 | x | 496 |
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-284 kJ/mol
H2O(l)═H2O(g)△H=+44kJ/mol
请回答下列问题
(1)请写出表示气态甲醇燃烧热的热化学方程式CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-757kJ•mol-1
(2)在低温情况下有利于一氧化碳和氢气制备甲醇的反应自发进行(填“高温”或“低温”),H-O的键能数据x的值为462
(3)甲醇燃料电池的结构示意图如图2.甲醇进入负极极(填“正”或“负”),正极发生的电极反应为O2+4e-+4H+=2H2O.
Ⅱ.一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.
(4)该反应的平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;根据图3,升高温度,K值将减小(填“增大”、“减小”或“不变”).
(5)判断该可逆反应达到化学平衡状态的标志是cdf(填字母).
a.v生成(CH3OH)=v消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度均不再变化.
3.氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色;下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、C1-)生产CuCl的流程如下:

根据以上信息回答下列问题:
(1)该生产过程还可以与氯碱工业、硫酸工业生产相结合,工业生产硫酸的方法名称是接触室,现代氯碱工业的装置名称是离子交换膜电解槽;
(2)写出生产过程中XFe YHCl (填化学式)
(3)写出产生CuCl的化学方程式CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4
(4)生产中为了提髙CuCl产品的质量,采用抽滤或者减压过滤_法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是减少产品CuCl的损失,生产过程中调节溶液的pH不能过大的原因是防止CuCl水解.
(5)在CuCl的生成过程中理论上不需要补充S02气体,其理由是Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1:1,CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2 H2SO4反应中消耗CuSO4和SO2也为1﹕1,所以理论上不需要补充SO2气体
(6)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是防止CuCl的氧化和见光分解
(7)工业氯化亚铜的定量分析:
①称取样品0.25g(称准至0.0002g)置于预先放人玻璃珠50粒和10mL过量的FeCl3溶液 250mL锥形瓶中,不断摇动;
②待样品溶解后加水50ml,邻菲罗啉指示剂2滴;
③立即用0.10mol L-1硫酸铈标准溶液滴至绿色出现为终点;同时做空白试验一次.已知:CuCl+FeCl3═CuCl2+FeCl2 Fe2++Ce4+═Fe3++Ce3+如此再重复二次测得
④数据处理:计算得该工业CuCl的纯度为95%.(平行实验结果相差不能超过0.3%)

根据以上信息回答下列问题:
(1)该生产过程还可以与氯碱工业、硫酸工业生产相结合,工业生产硫酸的方法名称是接触室,现代氯碱工业的装置名称是离子交换膜电解槽;
(2)写出生产过程中XFe YHCl (填化学式)
(3)写出产生CuCl的化学方程式CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4
(4)生产中为了提髙CuCl产品的质量,采用抽滤或者减压过滤_法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是减少产品CuCl的损失,生产过程中调节溶液的pH不能过大的原因是防止CuCl水解.
(5)在CuCl的生成过程中理论上不需要补充S02气体,其理由是Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1:1,CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2 H2SO4反应中消耗CuSO4和SO2也为1﹕1,所以理论上不需要补充SO2气体
(6)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是防止CuCl的氧化和见光分解
(7)工业氯化亚铜的定量分析:
①称取样品0.25g(称准至0.0002g)置于预先放人玻璃珠50粒和10mL过量的FeCl3溶液 250mL锥形瓶中,不断摇动;
②待样品溶解后加水50ml,邻菲罗啉指示剂2滴;
③立即用0.10mol L-1硫酸铈标准溶液滴至绿色出现为终点;同时做空白试验一次.已知:CuCl+FeCl3═CuCl2+FeCl2 Fe2++Ce4+═Fe3++Ce3+如此再重复二次测得
| 1 | 2 | 3 | |
| 空白实验消耗硫酸铈标准溶液的体积(mL) | 0.75 | 0.50 | 0.80 |
| 0.25克样品消耗硫酸铈标准溶液的体积(mL) | 24.65 | 24.75 | 24.70 |
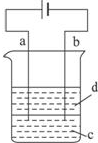 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.应用如图所示电解实验可制得白色纯净的Fe(OH)2沉淀.两电极的材料分别为石墨和铁.
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.应用如图所示电解实验可制得白色纯净的Fe(OH)2沉淀.两电极的材料分别为石墨和铁.