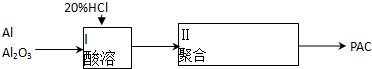
题目内容
12.写出化学方程式,一步完成.(1)Na→NaOH2Na+2H2O=2NaOH+H2↑;
(2)Al2O3→AlCl3Al2O3+6HCl=2AlCl3+3H2O;
(3)Fe(OH)2→Fe(OH)34Fe(OH)2+O2+2H2O═4Fe(OH)3
(4)Na2O2→Na2CO32Na2O2+2CO2═2Na2CO3+O2.
分析 (1)钠和水反应生成氢氧化钠和氢气;
(2)三氧化铝与盐酸反应生成氯化铝;
(3)氢氧化亚铁被空气中的氧气氧化生成氢氧化铁;
(4)过氧化钠与二氧化碳反应生成碳酸钠.
解答 解:(1)钠和水反应生成氢氧化钠和氢气,反应的化学方程式为:2Na+2H2O=2NaOH+H2↑;
故答案为:2Na+2H2O=2NaOH+H2↑;
(2)三氧化铝与盐酸反应生成氯化铝,化学方程式为:Al2O3+6HCl=2AlCl3+3H2O;
故答案为:Al2O3+6HCl=2AlCl3+3H2O;
(3)氢氧化亚铁被空气中的氧气氧化生成氢氧化铁,化学方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3;
故答案为:4Fe(OH)2+O2+2H2O═4Fe(OH)3;
(4)过氧化钠与二氧化碳反应生成碳酸钠,化学方程式为:2Na2O2+2CO2═2Na2CO3+O2;
故答案为:2Na2O2+2CO2═2Na2CO3+O2.
点评 本题考查了化学方程式的书写,题目难度不大,熟悉各种物质的性质是解题关键,注意对基础知识的巩固.

练习册系列答案
相关题目
2.下表是五种主族元素的结构特点及其元素、单质、化合物的性质.
(1)写出X元素的原子核外电子排布1s22s22p3;其单质的化学性质稳定(填“稳定”或“活泼”),该元素的非金属性强(填“强”或“弱”),证明其强弱的理由是硝酸是强酸.
(2)Z单质在空气中燃烧生成黄色粉末,写出该物质的电子式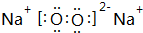 ;已知w 的氯化物在177.8°C时会发生升华现象,由此可以判断它的晶体类型为分子晶体.
;已知w 的氯化物在177.8°C时会发生升华现象,由此可以判断它的晶体类型为分子晶体.
(3)W的最高价氧化物对应水化物可以与X、Z的最高价氧化物对应水化物反应,写出反 应的离子方程式:Al(OH)3+3H+=Al3++3H2O,Al(OH)3+OH-=AlO2-+2H2O.
(4)一种元素有多种可变价态,一般高价氧化物对应水化物成酸,低价氧化物对应水化物成碱.Y、T可形成多种化合物,其中T元素的化合价为+3、+5时,形成的化合物的化学式为AB.
A.T2Y4 B.T4Y9 C.T6Y10 D.T2Y3.
| 元素 | 结构特点及元素、单质、化合物的性质 |
| X | 气态氢化物与最高价氧化物对应水化物可以化合成盐 |
| Y | 原子中s电子数与p电子数相同,且p电子的能量最高 |
| Z | 单质在空气中燃烧产生黄色火焰,生成黄色粉末 |
| W | 最外层电子排布(n+1)sn(n+1)pn-1 |
| T | 单质升华可以产生紫色的烟 |
(2)Z单质在空气中燃烧生成黄色粉末,写出该物质的电子式
 ;已知w 的氯化物在177.8°C时会发生升华现象,由此可以判断它的晶体类型为分子晶体.
;已知w 的氯化物在177.8°C时会发生升华现象,由此可以判断它的晶体类型为分子晶体.(3)W的最高价氧化物对应水化物可以与X、Z的最高价氧化物对应水化物反应,写出反 应的离子方程式:Al(OH)3+3H+=Al3++3H2O,Al(OH)3+OH-=AlO2-+2H2O.
(4)一种元素有多种可变价态,一般高价氧化物对应水化物成酸,低价氧化物对应水化物成碱.Y、T可形成多种化合物,其中T元素的化合价为+3、+5时,形成的化合物的化学式为AB.
A.T2Y4 B.T4Y9 C.T6Y10 D.T2Y3.
3.设为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 常温常压下,15g甲基(-CH3)所含的中子数为6NA | |
| B. | 一定条件下足量的Fe粉与浓硫酸反应,转移电子数一定为3NA | |
| C. | 在1L的碳酸钠溶液中,若c(CO32-)=1mol/L,则Na+个数为2NA | |
| D. | 含4NA个离子的固体Na2O2溶于水配成1L溶液,所得溶液中Na+的浓度为1mol/L |
7.用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一物质(括号内),溶液一定不能与原来溶液一样的是( )
| A. | CuCl2(CuCl2) | B. | AgNO3(Ag2O) | C. | NaCl(NaCl) | D. | CuSO4[Cu(OH)2] |
17.下列说法正确的是( )
| A. | 弱电解质一定是共价化合物 | |
| B. | 氨气溶于水,当c(OH-)=c(NH4+)时,表明NH3•H2O电离处于平衡状态 | |
| C. | 强电解质溶液中不存在溶质分子,弱电解质溶液中存在溶质分子 | |
| D. | 由0.1 mol•L-1一元碱BOH的pH=10,可知溶液中存在BOH═B++OH- |
1.在碱性溶液中,能大量共存的离子是( )
| A. | Mg2+、Fe3+、NO3-、K+ | B. | Al3+、Na+、Cl-、SO42- | ||
| C. | Na+、Ba2+、NO3-、Cl- | D. | K+、Na+、Cl-、HCO3- |

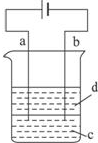 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.应用如图所示电解实验可制得白色纯净的Fe(OH)2沉淀.两电极的材料分别为石墨和铁.
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.应用如图所示电解实验可制得白色纯净的Fe(OH)2沉淀.两电极的材料分别为石墨和铁.