题目内容
2.某化工厂以丙烯、乙烯为原料进行化工生产的主要流程如图.下列有关说法错误的是( )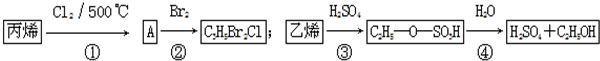
其中①CH3-CH=CH2+Cl2$\stackrel{500℃}{→}$Cl-CH2-CH=CH2+HCl.
| A. | 反应①与反应④均是取代反应 | |
| B. | 反应②与反应③均是加成反应 | |
| C. | 反应②中产物的结构简式为CH2BrCH2CHClBr | |
| D. | 反应③、④表明硫酸是乙烯与水反应的催化剂 |
分析 丙烯发生反应①,生成物A为能和溴反应,则A为Cl-CH2-CH=CH2,反应①是取代反应;
A和溴发生加成反应生成C3H5Br2Cl,所以反应②是加成反应;
根据乙烯和硫酸、二者反应产物分子式知,该反应为加成反应;C2H5OSO3H中-SO3H被H原子取代生成乙醇,所以④也是取代反应,据此分析解答.
解答 解:丙烯发生反应①,生成物A为能和溴反应,则A为Cl-CH2-CH=CH2,反应①是取代反应;
A和溴发生加成反应生成C3H5Br2Cl,所以反应②是加成反应;
根据乙烯和硫酸、二者反应产物分子式知,该反应为加成反应;C2H5OSO3H中-SO3H被H原子取代生成乙醇,所以④也是取代反应,
A.通过以上分析知,反应①与反应④均是取代反应,故A正确;
B.通过以上分析知,反应②与反应③均是加成反应,故B正确;
C.反应②中产物的结构简式为CH2ClCHBrCH2Br,故C错误;
D.硫酸在反应③中参加反应、在反应④生成,所以反应③、④表明硫酸是乙烯与水反应的催化剂,故D正确;
故选C.
点评 本题考查有机物推断、有机物结构和性质,为高频考点,侧重考查学生分析推断能力,明确反应前后结构简式区别是解本题关键,知道取代反应和加成反应区别,题目难度不大.

练习册系列答案
相关题目
12.烧杯中盛有一定量的液态物质A,加入少量固体物质B,B不溶解.当通入气体C时发现B逐渐溶解直至完全溶解.则A、B、C依次为( )
| A. | H2O、BaSO4、O2 | B. | FeCl2 溶液、Fe 粉、Cl2 | ||
| C. | H2O、CaCO3、SO3气体 | D. | H2O、SiO2、HCl 气体 |
13.下列有机化合物的分类不正确的是( )
| A. |  苯的同系物 | B. |  芳香烃 | C. |  卤代烃 | D. |  酯 |
17.下列电解质溶液的有关叙述正确的是( )
| A. | 在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-) | |
| B. | 在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 | |
| C. | 含1 mol KOH的溶液与1 mol CO2完全反应后,溶液中c(K+)=c(HCO${\;}_{3}^{-}$) | |
| D. | 同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7 |
7.下列实验操作或记录正确的是( )
| A. | 常温常压下测得1 mol N2 的质量为 28 g | |
| B. | 用量筒测得排水法收集制得的氢气体积为 50.28 mL | |
| C. | 用两只250 mL的容量瓶配置0.1 mol/L 500 mL 的 NaOH 溶液 | |
| D. | 用托盘天平称得 2.50 g 胆矾,受热充分失水后,固体质量减轻 0.90 g |
14.“保护环境,就是保护人类自己.”下列环境问题与产生的主要原因不相符的是( )
①“臭氧空洞”主要是大量使用氟氯代烃等引起的
②“光化学烟雾”主要是由NO2等引起的
③“酸雨”主要是由空气中CO2浓度增大引起的
④“白色污染”主要是由聚乙烯塑料等引起的
⑤“厄尔尼诺”现象是由空气中CO2浓度增大引起的
⑥“温室效应”主要是由空气中CO2浓度增大引起的
⑦“赤潮”主要是由水体中P、N等元素过量引起的.
①“臭氧空洞”主要是大量使用氟氯代烃等引起的
②“光化学烟雾”主要是由NO2等引起的
③“酸雨”主要是由空气中CO2浓度增大引起的
④“白色污染”主要是由聚乙烯塑料等引起的
⑤“厄尔尼诺”现象是由空气中CO2浓度增大引起的
⑥“温室效应”主要是由空气中CO2浓度增大引起的
⑦“赤潮”主要是由水体中P、N等元素过量引起的.
| A. | 只有①② | B. | 只有②③⑤ | C. | 全部 | D. | 只有③ |
11.密度为0.910g/cm3氨水,质量分数为25.0%,该氨水用等体积的水稀释后,所得溶液的质量分数为( )
| A. | 等于12.5% | B. | 大于12.5% | C. | 小于12.5% | D. | 无法确定 |
12.已知在101kPa、25℃条件下,已知1g氢气燃烧生成液态水放出142.9kJ的热量,则下列热化学方程式正确的是( )
| A. | 2H2(g)+O2(g)═2H2O(l);△H=-142.9kJ/mol | B. | 2H2(g)+O2(g)═2H2O(l);△H=-571.6kJ/mol | ||
| C. | 2H2+O2═2H2O;△H=-571.6kJ/mol | D. | 2H2(g)+O2(g)═2H2O(l);△H=+571.6kJ/mol |