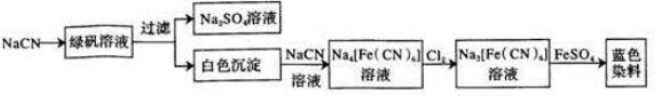
题目内容
12.已知在101kPa、25℃条件下,已知1g氢气燃烧生成液态水放出142.9kJ的热量,则下列热化学方程式正确的是( )| A. | 2H2(g)+O2(g)═2H2O(l);△H=-142.9kJ/mol | B. | 2H2(g)+O2(g)═2H2O(l);△H=-571.6kJ/mol | ||
| C. | 2H2+O2═2H2O;△H=-571.6kJ/mol | D. | 2H2(g)+O2(g)═2H2O(l);△H=+571.6kJ/mol |
分析 25℃、101kPa下,1g氢气完全燃烧生成液态水时放出热量142.9kJ,则4g氢气燃烧生成液态水,放出571.6kJ热量,热化学方程式应为2H2(g)+O2(g)═2H2O(1)△H=-571.6 kJ•mol-1,以此解答该题.
解答 解:已知1g氢气燃烧生成液态水放出142.9kJ的热量,4g氢气燃烧生成液态水,放出571.6kJ热量,
A、4g氢气燃烧生成液态水,放出热量571.6kJ,不是142.9kJ,同时物质聚集状态未标注,故A错误;
B、4g氢气燃烧生成液态水,放出热量571.6kJ,故B正确;
C、4g氢气燃烧生成液态水,放出571.6kJ热量,放热时焓变值为负值,需要物质聚集状态标注,故C错误;
D、4g氢气燃烧生成液态水,放出热量571.6kJ,放热时焓变值为负值,故D错误;
故选B.
点评 本题主要考查热化学方程式的书写方法及系数的含义,注意焓变的正负和物质的状态,掌握基础是解题关键,题目较简单.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.某化工厂以丙烯、乙烯为原料进行化工生产的主要流程如图.下列有关说法错误的是( )
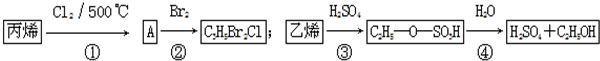
其中①CH3-CH=CH2+Cl2$\stackrel{500℃}{→}$Cl-CH2-CH=CH2+HCl.

其中①CH3-CH=CH2+Cl2$\stackrel{500℃}{→}$Cl-CH2-CH=CH2+HCl.
| A. | 反应①与反应④均是取代反应 | |
| B. | 反应②与反应③均是加成反应 | |
| C. | 反应②中产物的结构简式为CH2BrCH2CHClBr | |
| D. | 反应③、④表明硫酸是乙烯与水反应的催化剂 |
20.下列描述涉及化学变化的是( )
| A. | 山崩地裂 | B. | 百炼成钢 | C. | 木已成舟 | D. | 花香四溢 |
7.工业上为了处理含有Cr2O${\;}_{7}^{2-}$的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以铁为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬元素的含量已低于排放标准.关于上述方法,下列说法错误的是( )
| A. | 阳极反应:Fe-2e-═Fe2+ | |
| B. | 阴极反应:2H++2e-═H2↑ | |
| C. | 在电解过程中工业废水由酸性变为碱性 | |
| D. | 可以将铁电极改为石墨电极 |
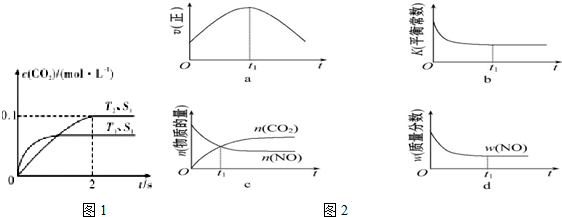
1. 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(1)写出该反应的平衡常数表达式 K=$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)c({O}_{2})}$.已知:K300°C>K350°C,则该反应是放热 反应.(填“吸热”或者“放热”)
(2)图中表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v=1.5×10-3mol•L-1•s-1.
(3)能说明该反应已达到平衡状态的是be.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.NO、O2、NO2的浓度之比为2:1:2 d.容器内密度保持不变 e.容器内气体的颜色不再变化
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的措施是增大反应物的浓度.
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v=1.5×10-3mol•L-1•s-1.
(3)能说明该反应已达到平衡状态的是be.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.NO、O2、NO2的浓度之比为2:1:2 d.容器内密度保持不变 e.容器内气体的颜色不再变化
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的措施是增大反应物的浓度.


 .
.  .
.