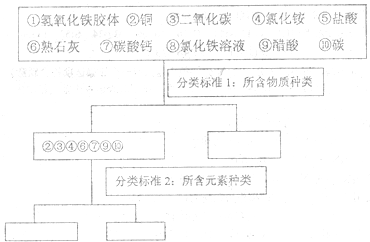
题目内容
11.密度为0.910g/cm3氨水,质量分数为25.0%,该氨水用等体积的水稀释后,所得溶液的质量分数为( )| A. | 等于12.5% | B. | 大于12.5% | C. | 小于12.5% | D. | 无法确定 |
分析 依据加水稀释前后溶质的质量不变,该氨水用等体积的水稀释后,所得氨水的质量为水的质量加上原有氨水的质量,所得氨水溶液的溶质为质量分数为25%的氨水中的溶质,据此解答即可.
解答 解:设加入水的体积为V,那么质量分数为25%的氨水的体积也为V,该氨水用等体积的水稀释后,所得溶液中溶质的质量分数为:$\frac{V×0.91g/cm3×25%}{V×0.91g/cm3+V×1.0g/cm3}$×100%≈11.9%<12.5%,
故选C.
点评 本题主要考查的是溶液的稀释,抓住溶液稀释前后溶质的质量不变是解决此类题的方法,难度不大.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
2.某化工厂以丙烯、乙烯为原料进行化工生产的主要流程如图.下列有关说法错误的是( )
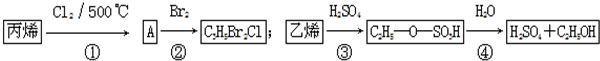
其中①CH3-CH=CH2+Cl2$\stackrel{500℃}{→}$Cl-CH2-CH=CH2+HCl.

其中①CH3-CH=CH2+Cl2$\stackrel{500℃}{→}$Cl-CH2-CH=CH2+HCl.
| A. | 反应①与反应④均是取代反应 | |
| B. | 反应②与反应③均是加成反应 | |
| C. | 反应②中产物的结构简式为CH2BrCH2CHClBr | |
| D. | 反应③、④表明硫酸是乙烯与水反应的催化剂 |
19.下述实验操作中,正确的是( )
| A. | 配置硫酸溶液时,将浓硫酸慢慢注入盛有水的容量瓶中进行配制 | |
| B. | 用托盘天平称量8.75g NaCl固体 | |
| C. | 将混合液蒸馏分离时,应使温度计水银球浸没在混合液中 | |
| D. | 分液时,将上层液体从分液漏斗上口倒出,下层液体从分液漏斗下口放出 |
20.下列描述涉及化学变化的是( )
| A. | 山崩地裂 | B. | 百炼成钢 | C. | 木已成舟 | D. | 花香四溢 |
1. 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(1)写出该反应的平衡常数表达式 K=$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)c({O}_{2})}$.已知:K300°C>K350°C,则该反应是放热 反应.(填“吸热”或者“放热”)
(2)图中表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v=1.5×10-3mol•L-1•s-1.
(3)能说明该反应已达到平衡状态的是be.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.NO、O2、NO2的浓度之比为2:1:2 d.容器内密度保持不变 e.容器内气体的颜色不再变化
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的措施是增大反应物的浓度.
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v=1.5×10-3mol•L-1•s-1.
(3)能说明该反应已达到平衡状态的是be.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.NO、O2、NO2的浓度之比为2:1:2 d.容器内密度保持不变 e.容器内气体的颜色不再变化
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的措施是增大反应物的浓度.