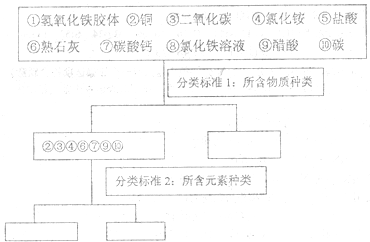
题目内容
12.烧杯中盛有一定量的液态物质A,加入少量固体物质B,B不溶解.当通入气体C时发现B逐渐溶解直至完全溶解.则A、B、C依次为( )| A. | H2O、BaSO4、O2 | B. | FeCl2 溶液、Fe 粉、Cl2 | ||
| C. | H2O、CaCO3、SO3气体 | D. | H2O、SiO2、HCl 气体 |
分析 液态物质A,加入少量固体物质B,B不溶解.当通入气体C时发现B逐渐溶解直至完全溶解,可知B不溶于水,A、B不反应,而C物质具有强氧化性或与B反应,以此来解答.
解答 解:A.H2O中加入BaSO4不溶解,通入O2,BaSO4不溶解,故A错误;
B.FeCl2溶液中加入Fe粉不溶解,通入Cl2,氧化氯化亚铁为氯化铁,氯化铁可以溶解铁,故B正确;
C、H2O中加入CaCO3不溶解,通入SO3气体形成硫酸沉淀溶解但不完全,因为硫酸钙是微溶物,故C错误;
D、H2O中加入SiO2不溶解,通入HCl气体沉淀不溶解,故D错误;
故选B.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、发生的反应为解答该题的关键,侧重分析和应用能力的考查,注意氧化还原反应的应用,题目难度不大.

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案
相关题目
3.氮氧化物与悬浮在大气中的海盐粒子会发生下列反应4NO2(g)+2NaCl(s)═2NaNO3(s)+2NO(g)+C l2(g),△H在恒温条件下,向2L恒容密闭容器中加入0.4mol NO2和0.2mol NaCl,10min反应达到平衡,此时n(NaNO3)=0.1mol.下列叙述中正确的是( )
| A. | 0~10min内,v(NO)=0.01mol.L-1.min-1 | |
| B. | 若保持其他条件下不变,加入催化剂,则△H不变 | |
| C. | 若升高温度,平衡向逆反应方向移动,则△H>0 | |
| D. | 若平衡后向容器中再加入0.1mol NaCl,则NO2的转化率增大 |
20.观察下列几个装置示意图,有关叙述不正确的是( )


| A. | 装置①中阴极上析出红色固体 | |
| B. | 装置②的待镀铁制品应与电源负极相连 | |
| C. | 装置③中a为负极,发生的电极反应式为H2+2OH-+2e-═2H2O | |
| D. | 装置④中在阴极可以得到氢气和氢氧化钠,离子交换膜可选用阳离子交换膜 |
2.某化工厂以丙烯、乙烯为原料进行化工生产的主要流程如图.下列有关说法错误的是( )
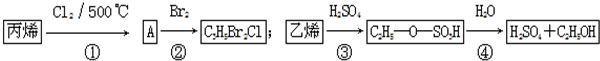
其中①CH3-CH=CH2+Cl2$\stackrel{500℃}{→}$Cl-CH2-CH=CH2+HCl.

其中①CH3-CH=CH2+Cl2$\stackrel{500℃}{→}$Cl-CH2-CH=CH2+HCl.
| A. | 反应①与反应④均是取代反应 | |
| B. | 反应②与反应③均是加成反应 | |
| C. | 反应②中产物的结构简式为CH2BrCH2CHClBr | |
| D. | 反应③、④表明硫酸是乙烯与水反应的催化剂 |
 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和l00g 10.00%的K2SO4溶液.电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和l00g 10.00%的K2SO4溶液.电极均为石墨电极. 信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门.
信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门.