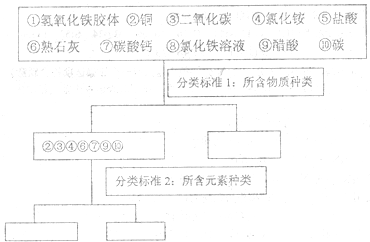
题目内容
13.下列有机化合物的分类不正确的是( )| A. |  苯的同系物 | B. |  芳香烃 | C. |  卤代烃 | D. |  酯 |
分析 A、苯的同系物符合:①只有一个苯环;②侧链为烷基;③具有通式CnH2n-6(n≥6);
B、含苯环的烃为芳香烃;
C、用卤素原子取代了烃中的氢原子所生成的有机物为卤代烃;
D、含酯基-COO-的有机物为酯类.
解答 解:A. 中不含苯环,不是苯的同系物,属于环烷烃,故A错误;
中不含苯环,不是苯的同系物,属于环烷烃,故A错误;
B、含苯环的烃为芳香烃, 中只含碳氢两种元素,故为烃类,且含苯环,故为芳香烃,故B正确;
中只含碳氢两种元素,故为烃类,且含苯环,故为芳香烃,故B正确;
C、用卤素原子取代了烃中的氢原子所生成的有机物为卤代烃, 为用-Cl取代了苯中的一个氢原子得到的,故为卤代烃,故C正确;
为用-Cl取代了苯中的一个氢原子得到的,故为卤代烃,故C正确;
D、含酯基-COO-的有机物为酯类,而 中含酯基,故为酯类,故D正确.
中含酯基,故为酯类,故D正确.
故选A.
点评 本题考查有机物的分类、结构,比较基础,注意对概念的理解.掌握常见的有机物的官能团是解题的关键.

练习册系列答案
相关题目
3.氮氧化物与悬浮在大气中的海盐粒子会发生下列反应4NO2(g)+2NaCl(s)═2NaNO3(s)+2NO(g)+C l2(g),△H在恒温条件下,向2L恒容密闭容器中加入0.4mol NO2和0.2mol NaCl,10min反应达到平衡,此时n(NaNO3)=0.1mol.下列叙述中正确的是( )
| A. | 0~10min内,v(NO)=0.01mol.L-1.min-1 | |
| B. | 若保持其他条件下不变,加入催化剂,则△H不变 | |
| C. | 若升高温度,平衡向逆反应方向移动,则△H>0 | |
| D. | 若平衡后向容器中再加入0.1mol NaCl,则NO2的转化率增大 |
8.NH3经一系列反应可以得到HNO3,如图所示.
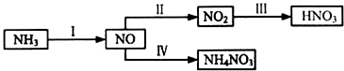
(1)已知反应N2(g)+3H2(g)?2NH3(g)△H,在恒压密闭容器中达到平衡状态.
①根据表中所列键能数据,可得△H=3a+c-6b kJ•mol-1.(用含a、b、c的式子表示)
②往上述平衡体系中充入氩气,此时v (N2)正减小(填“增大”、“减小”或“不变”)
(2)某温度下,密闭容器发生反应N2O4(g)?2NO2(g),
相互转化时的量变关系如图所示.请回答:
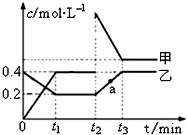
①代表乙的物质是N2O4(填“N2O4”或“NO2”)
②反应进行到t2时刻,改变的条件可能是增大NO2的浓度
③已知:N2(g)+O2(g)?2NO(g)△H=+180.5kJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)?CO2(g)△H=-283kJ•mol-1
治理汽车尾气过程中,将NO和CO转化成CO2和N2的反应的热化学方程式为2CO(g)+2NO(g)?2CO2(g)+N2(g)△H=-746.5 kJ•mol-1
(3)电解NO制备 NH4NO3的工作原理如图所示,
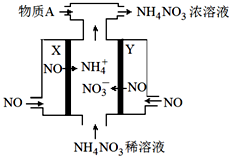
总反应为:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2HNO3
①NH4NO3溶液中离子浓度由大到小顺序为c(NO3-)>c(NH4+)>c(H+)>c(OH-)
②X极的电极反应为NO+6H++5e-=NH4++H2O
③为使电解过程中阳极产生的NO3-与阴极产生的NH4+全部转化为NH4NO3,需补充的物质A为NH3(填化学式)

(1)已知反应N2(g)+3H2(g)?2NH3(g)△H,在恒压密闭容器中达到平衡状态.
①根据表中所列键能数据,可得△H=3a+c-6b kJ•mol-1.(用含a、b、c的式子表示)
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | a | b | c |
(2)某温度下,密闭容器发生反应N2O4(g)?2NO2(g),
相互转化时的量变关系如图所示.请回答:

①代表乙的物质是N2O4(填“N2O4”或“NO2”)
②反应进行到t2时刻,改变的条件可能是增大NO2的浓度
③已知:N2(g)+O2(g)?2NO(g)△H=+180.5kJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)?CO2(g)△H=-283kJ•mol-1
治理汽车尾气过程中,将NO和CO转化成CO2和N2的反应的热化学方程式为2CO(g)+2NO(g)?2CO2(g)+N2(g)△H=-746.5 kJ•mol-1
(3)电解NO制备 NH4NO3的工作原理如图所示,

总反应为:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2HNO3
①NH4NO3溶液中离子浓度由大到小顺序为c(NO3-)>c(NH4+)>c(H+)>c(OH-)
②X极的电极反应为NO+6H++5e-=NH4++H2O
③为使电解过程中阳极产生的NO3-与阴极产生的NH4+全部转化为NH4NO3,需补充的物质A为NH3(填化学式)
18.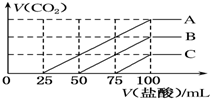 浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol•L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.下列判断正确的是( )
浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol•L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.下列判断正确的是( )
 浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol•L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.下列判断正确的是( )
浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol•L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.下列判断正确的是( )| A. | 原NaOH溶液的浓度为0.2 mol•L-1 | |
| B. | B烧杯中通入的CO2体积为448 mL | |
| C. | 通入CO2后,不能确定A烧杯中的溶质 | |
| D. | 通入CO2后,C烧杯中溶质成分为NaOH和 Na2CO3,且物质的量相等 |
5.1mol 下列物质与足量的NaOH溶液充分反应,消耗的NaOH的物质的量为( )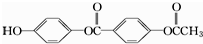

| A. | 3 mol | B. | 4mol | C. | 5 mol | D. | 6 mol |
2.某化工厂以丙烯、乙烯为原料进行化工生产的主要流程如图.下列有关说法错误的是( )
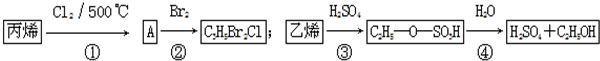
其中①CH3-CH=CH2+Cl2$\stackrel{500℃}{→}$Cl-CH2-CH=CH2+HCl.

其中①CH3-CH=CH2+Cl2$\stackrel{500℃}{→}$Cl-CH2-CH=CH2+HCl.
| A. | 反应①与反应④均是取代反应 | |
| B. | 反应②与反应③均是加成反应 | |
| C. | 反应②中产物的结构简式为CH2BrCH2CHClBr | |
| D. | 反应③、④表明硫酸是乙烯与水反应的催化剂 |
 信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门.
信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门.