题目内容
7.下列实验操作或记录正确的是( )| A. | 常温常压下测得1 mol N2 的质量为 28 g | |
| B. | 用量筒测得排水法收集制得的氢气体积为 50.28 mL | |
| C. | 用两只250 mL的容量瓶配置0.1 mol/L 500 mL 的 NaOH 溶液 | |
| D. | 用托盘天平称得 2.50 g 胆矾,受热充分失水后,固体质量减轻 0.90 g |
分析 A.结合m=nM分析;
B.量筒只能读到0.1mL;
C.容量瓶只能配置与瓶上所标的体积相同的溶液,两只容量瓶配制的溶液浓度不同,有误差;
D.托盘天平称量物质准确度为0.1g.
解答 解:A.常温常压下测得1mol N2的质量为1mol×28g/mol=28g,故A正确;
B.量筒量取液体体积的准确度为0.1mL,所以用量筒测得排水法收集制得的氢气体积不能是小数点后两位,故B错误;
C.两只容量瓶配制的溶液浓度不同,误差较大,故C错误;
D.托盘天平称量物质准确度为0.1g,所以不能称取2.50g胆矾,故D错误;
故选A.
点评 本题考查化学实验方案的评价,涉及对一些测量仪器的准确度及仪器规格的掌握情况,难度较大,注意:容量瓶只能配置与瓶上所标的体积相同的溶液.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案
相关题目
18.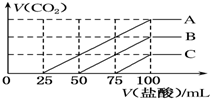 浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol•L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.下列判断正确的是( )
浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol•L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.下列判断正确的是( )
 浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol•L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.下列判断正确的是( )
浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol•L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.下列判断正确的是( )| A. | 原NaOH溶液的浓度为0.2 mol•L-1 | |
| B. | B烧杯中通入的CO2体积为448 mL | |
| C. | 通入CO2后,不能确定A烧杯中的溶质 | |
| D. | 通入CO2后,C烧杯中溶质成分为NaOH和 Na2CO3,且物质的量相等 |
15.下列叙述中正确的是( )
| A. | 硝酸的摩尔质量是63 g | |
| B. | 1 mol CO的质量是28 g | |
| C. | 4 g氢气对应的摩尔质量是2 g氢气对应的摩尔质量的2倍 | |
| D. | 铁的摩尔质量在数值上等于铁原子的相对原子质量 |
2.某化工厂以丙烯、乙烯为原料进行化工生产的主要流程如图.下列有关说法错误的是( )
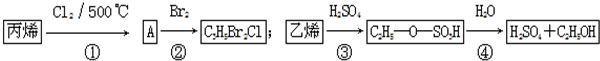
其中①CH3-CH=CH2+Cl2$\stackrel{500℃}{→}$Cl-CH2-CH=CH2+HCl.

其中①CH3-CH=CH2+Cl2$\stackrel{500℃}{→}$Cl-CH2-CH=CH2+HCl.
| A. | 反应①与反应④均是取代反应 | |
| B. | 反应②与反应③均是加成反应 | |
| C. | 反应②中产物的结构简式为CH2BrCH2CHClBr | |
| D. | 反应③、④表明硫酸是乙烯与水反应的催化剂 |
12.在汽车排气管加装催化装置,可有效减少CO和NOx的排放,催化装置内发生反应为:NOx+CO$\stackrel{催化剂}{→}$N2+CO2下列关于此反应的说法中错误的是( )
| A. | 等物质的量N2和CO2中,共用电子对的个数比为3:4 | |
| B. | 该反应中化合价变化的有N和C元素 | |
| C. | 氧化剂与还原剂的物质的量之比为1:1时,NOx中氮元素的化合价为+2价 | |
| D. | 当x=2时,每生成1mol N2,转移电子数为4mol |
19.下述实验操作中,正确的是( )
| A. | 配置硫酸溶液时,将浓硫酸慢慢注入盛有水的容量瓶中进行配制 | |
| B. | 用托盘天平称量8.75g NaCl固体 | |
| C. | 将混合液蒸馏分离时,应使温度计水银球浸没在混合液中 | |
| D. | 分液时,将上层液体从分液漏斗上口倒出,下层液体从分液漏斗下口放出 |

