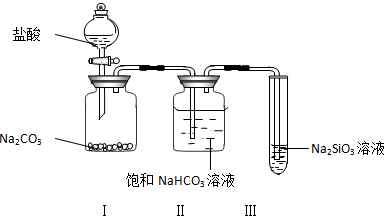
题目内容
2.在室温下,等体积的酸和碱溶液混合后pH一定小于7的是( )| A. | pH=3的HNO 3与pH=11的KOH溶液 | |
| B. | pH=3的HNO 3与pH=11的氨水 | |
| C. | pH=3的H 2SO 4与pH=11的NaOH溶液 | |
| D. | pH=3的CH 3COOH与pH=11的Ba(OH) 2溶液 |
分析 A.硝酸和氢氧化钾都是强电解质,两溶液恰好反应,溶液呈中性;
B.氨水为弱碱,混合液中氨水过量,溶液呈碱性;
C.硫酸和氢氧化钠都是强电解质,两溶液恰好反应,溶液呈中性;
D.醋酸为弱酸,混合液中醋酸过量,溶液呈酸性.
解答 解:A.pH=3的硝酸中c(H+)=1×10-3mol/L,pH=11的氢氧化钾溶液中c(OH-)=1×10-3mol/L,在室温下等体积混合后pH=7,故A错误;
B.pH=3的稀释中c(H+)=1×10-3mol/L,pH=11的氨水中c(OH-)=1×10-3mol/L,由于氨水为弱碱,则氨水过量,在室温下等体积混合后,pH>7,故B错误;
C.pH=3的硫酸中c(H+)=1×10-3mol/L,pH=11的氢氧化钠溶液中c(OH-)=1×10-3mol/L,两溶液混合后恰好反应,常温下溶液的pH=7,故C错误;
D.pH=3的醋酸c(H+)=1×10-3mol/L,pH=11的氢氧化钡溶液中c(OH-)=1×10-3mol/L,由于醋酸为弱酸,则醋酸过量,在室温下等体积混合后,pH<7,故D正确;
故选D.
点评 本题考查酸碱混合时的定性判断及有关pH的计算,题目难度不大,明确溶液酸碱性与溶液pH的关系为解答关键,注意弱电解质的电离特点,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
13.现代生活中,光污染已经给人类的生活和身体带来了极大的危害.据光学专家研究,镜面建筑物玻璃的反射光比阳光照射更强烈,其反射率高达82%到90%.长时间在白色光亮污染环境下工作和生活的人,容易导致视力下降,产生头昏目眩、心悸、情绪低落等症状,影响正常生活.某校在草地上立了一个金属材质的水滴造型,寓意滴水之恩,光亮如镜.但其超强的反射性直接影响了众多办公室.现有化学实验小组欲对其进行适当的腐蚀化处理,请选出腐蚀速度最快的方法( )

| A. | 将水滴造型与锌块相连 | B. | 将水滴造型与电源的负极相连 | ||
| C. | 将水滴造型与电源的正极相连 | D. | 进行多次人工降雨 |
10.反应4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O是工业制硝酸的重要一步,有关该反应的说法正确的是( )
| A. | NH3是氧化剂 | B. | NH3被氧化 | ||
| C. | NO只是还原剂 | D. | 生成60gNO转移的5mol电子 |
17.某反应过程能量变化如图所示,下列说法正确的是( )


| A. | 改变催化剂,可改变该反应的活化能 | |
| B. | 该反应为放热反应,热效应等于E 1-E 2 | |
| C. | 反应过程 a 有催化剂参与 | |
| D. | 有催化剂条件下,反应的活化能等于 E 1+E 2 |
12.关于反应CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2的说法不正确的是( )
| A. | 该反应是氧化还原反应 | B. | Cu是氧化剂 | ||
| C. | CO是还原剂 | D. | 该反应中有电子转移 |
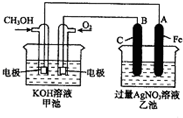 如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O
如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O