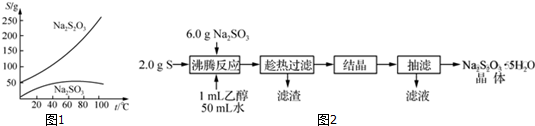
��Ŀ����
7��ijͬѧΪ��֤���ᡢ̼����������ǿ��������ͼװ�ý���ʵ�飺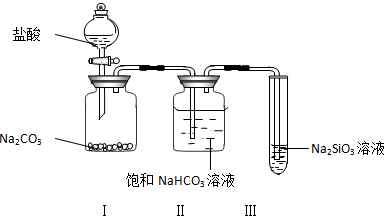
�ش��������⣮
��1��װ�â��е������ǹ����ܽ������������ɣ�װ�â������������CO2�л��е�HCl���壬���п��ܷ�����Ӧ�����ӷ���ʽ��H++HCO3-=CO2��+H2O��
��2��װ�â��е��������а�ɫ�����������н�״���������Ӧ�Ļ�ѧ����ʽ��CO2+H2O+Na2SiO3=H2SiO3��+Na2CO3��
��3����ʵ���ʵ����������ԣ����̼����ᣮ
���� ��1��̼���ƺ����ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼��������лӷ��ԣ���̼���ƺ�ϡ���ᷴӦΪ���ȷ�Ӧ�����ɵĶ�����̼�к���HCl������̼�������ܺ�HCl��Ӧ���Ͷ�����̼����Ӧ��
��2��̼�����Դ��ڹ��ᣬ������̼ͨ���������Һ���������ԵĹ������ɣ�
��3��ǿ���ܺ������η�Ӧ�������ᣮ
��� �⣺��1��̼���ƺ����ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼������I�п��ܵ������ǹ����ܽ������������ɣ�������лӷ��ԣ���̼���ƺ�ϡ���ᷴӦΪ���ȷ�Ӧ�����ɵĶ�����̼�к���HCl������̼�������ܺ�HCl��Ӧ���Ͷ�����̼����Ӧ������II��Ŀ�������ն�����̼�л��е�HCl�����ӷ���ʽΪH++HCO3-=CO2��+H2O��
�ʴ�Ϊ�������ܽⲢ�����ݲ���������CO2�л��е�HCl���壻H++HCO3-=CO2��+H2O��
��2��̼�����Դ��ڹ��ᣬ������̼ͨ���������Һ���������ԵĹ������ɣ����Կ������������а�ɫ�����������н�״���������Ӧ����ʽΪCO2+H2O+Na2SiO3=H2SiO3��+Na2CO3���ʴ�Ϊ���а�ɫ�����������н�״�������CO2+H2O+Na2SiO3=H2SiO3��+Na2CO3��
��3��ǿ���ܺ������η�Ӧ�������ᣬͨ�����Ϸ���֪����������ȡ̼�ᡢ̼������ȡ���ᣬ�������ԣ����̼����ᣬ�ʴ�Ϊ�����ԣ����̼����ᣮ
���� ������ǿ����ȡ����Ϊ���忼������ѧʵ�飬���ؿ���ѧ��ʵ��������۲켰�ܽ������������ȷʵ��ԭ�����������������ǽⱾ��ؼ��������ʵ����������ܽ���ɣ���Ŀ�ѶȲ���

 ���������ʱ��ѵϵ�д�
���������ʱ��ѵϵ�д� �㽭�¿γ���άĿ�������ʱ��ѵϵ�д�
�㽭�¿γ���άĿ�������ʱ��ѵϵ�д� ��������ϵ�д�
��������ϵ�д� ���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�
���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д���1��Ŀǰ��ҵ����һ�ַ�������CO2��H2��230��������������ɼ״�������ˮ������ͼ��ʾ��ѹ������0.5molCO2��1.5molH2ת���ʴ�80%ʱ�������仯ʾ��ͼ��
�����жϸ÷�Ӧ������Ӧ������е��ǣ�B
A��v����H2��=3v����CH3OH��

B�������л��������ܶȱ��
C��������ѹǿ����
D.2��C=O���ѵ�ͬʱ��6��H-H�γ�
��������Ӧ�����������ֲ��䣬�ں��������½��У�ƽ��ʱH2��ת���ʽ���С��������С�����䡱��
��д��������Ӧ���Ȼ�ѧ����ʽ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-49kJ•mol-1
��2������ͬ����CO��g����H2O��g���ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У����з�ӦCO��g��+H2O��g���TCO2��g��+H2��g�����õ������������ݣ�
| ʵ���� | �¶ȡ� | ��ʼ��mol | ƽ����mol | ��ƽ������ʱ��min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
��ʵ��3�У���ƽ��ʱ��CO��ת���ʴ���ˮ��������a/b��ֵ��$\frac{1}{6}$�������ֵ��ȡֵ��Χ��
��ʵ��4����900��ʱ���ڴ������м���CO��H2O��CO2��H2��Ϊ2mol�����ʱv����v�����������������=����
��3���״���һ����������ת��Ϊ��ȩ�������ζ����Dzⶨ��ȩ�Ļ�ѧ����֮һ����ԭ�����ڼ��Խ��ʣ�NaOH���У���ת��Ϊ�ε����ƺ͵⻯�ƣ�����Һ������ļ�ȩ����Ϊ�����ƣ����ʵ��ữ��ʣ��Ĵε����ƺ͵⻯�������ɵ⣬���������м�ȩ����Ļ�ѧ��Ӧ�����ӷ���ʽΪ��HCHO+IO-+OH-=HCOO-+I-+H2O��
| A�� | pH=3��HNO 3��pH=11��KOH��Һ | |
| B�� | pH=3��HNO 3��pH=11�İ�ˮ | |
| C�� | pH=3��H 2SO 4��pH=11��NaOH��Һ | |
| D�� | pH=3��CH 3COOH��pH=11��Ba��OH�� 2��Һ |
 ����һ�ֿɽ���ľ�����߷��Ӳ��ϣ��ڲ��ϵ����������Է����кܺõ�Ӧ��ǰ����PPG��һ�ֺϳ�·�����£�
����һ�ֿɽ���ľ�����߷��Ӳ��ϣ��ڲ��ϵ����������Է����кܺõ�Ӧ��ǰ����PPG��һ�ֺϳ�·�����£�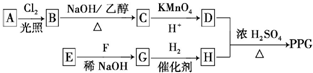
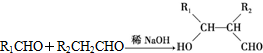

 ��
�� ��
�� ��
��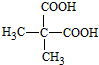
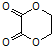 �ĺϳ�·������ͼ�����Լ���ѡ�����ϳ�·������ͼʾ�����£�CH3CH2Br$��_{����}^{NaOH/��}$CH2=CH2$��_{����}^{H_{2}O}$CH3CH2OH��
�ĺϳ�·������ͼ�����Լ���ѡ�����ϳ�·������ͼʾ�����£�CH3CH2Br$��_{����}^{NaOH/��}$CH2=CH2$��_{����}^{H_{2}O}$CH3CH2OH��