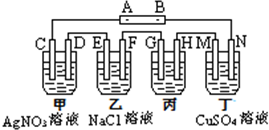
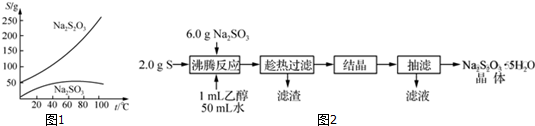
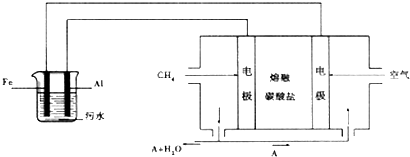
题目内容
10.反应4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O是工业制硝酸的重要一步,有关该反应的说法正确的是( )| A. | NH3是氧化剂 | B. | NH3被氧化 | ||
| C. | NO只是还原剂 | D. | 生成60gNO转移的5mol电子 |
分析 该反应中N元素化合价由-3价变为+2价、O元素化合价由0价变为-2价,失电子化合价升高的反应物是还原剂、得电子化合价降低的反应物是氧化剂,反应过程中氧化剂被还原、还原剂被氧化,据此分析解答.
解答 解:该反应中N元素化合价由-3价变为+2价、O元素化合价由0价变为-2价,
A.得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,氧气得电子,所以氧气是氧化剂,氨气失电子,所以氨气是还原剂,故A错误;
B.氨气是还原剂,在反应中被氧化,故B正确;
C.NO既是氧化产物也是还原产物,故C错误;
D.60gNO的物质的量=$\frac{60g}{30g/mol}$=2mol,生成2molNO转移电子物质的量=2mol×[2-(-3)]=10mol,故D错误;
故选B.
点评 本题考查氧化还原反应,为高频考点,侧重考查基本概念和基本计算,明确元素化合价变化与基本概念之间关系、物质与转移电子之间的关系是解本题关键,熟悉常见元素化合价.

练习册系列答案
相关题目
1.使用容器瓶配制溶液时,由于操作不当会引起误差,下列情况会使所配溶液浓度偏高的是( )
| A. | 溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤 | |
| B. | 转移溶液前容量瓶内有少量蒸馏水 | |
| C. | 定容时,俯视容量瓶的刻度线 | |
| D. | 定容摇匀时,发现液面降低,又补加少量水,重新达到刻度线 |
2.在室温下,等体积的酸和碱溶液混合后pH一定小于7的是( )
| A. | pH=3的HNO 3与pH=11的KOH溶液 | |
| B. | pH=3的HNO 3与pH=11的氨水 | |
| C. | pH=3的H 2SO 4与pH=11的NaOH溶液 | |
| D. | pH=3的CH 3COOH与pH=11的Ba(OH) 2溶液 |

 )是一种可降解的聚酯类高分子材料,在材料的生物相容性方面有很好的应用前景.PPG的一种合成路线如下:
)是一种可降解的聚酯类高分子材料,在材料的生物相容性方面有很好的应用前景.PPG的一种合成路线如下: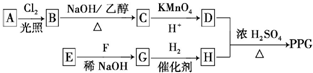
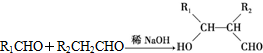

 .
. .
. .
.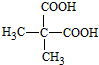
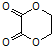 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br$→_{加热}^{NaOH/醇}$CH2=CH2$→_{催化剂}^{H_{2}O}$CH3CH2OH.
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br$→_{加热}^{NaOH/醇}$CH2=CH2$→_{催化剂}^{H_{2}O}$CH3CH2OH.