题目内容
10.向氯化亚铁溶液中加入过量的氨水,有沉淀生成.过滤.加热沉淀物至质量不再发声变化,得到红棕色的残渣.上述沉淀和残渣分别为( )| A. | Fe(OH)2、Fe(OH)3;Fe3O4 | B. | Fe(OH)2;FeO | ||
| C. | Fe(OH)2、Fe(OH)3;Fe2O3 | D. | Fe2O3;Fe(OH)3 |
分析 得到红棕色的残渣,可知为Fe2O3,则氢氧化铁加热分解生成氧化铁,以此来解答.
解答 解:得到红棕色的残渣,可知为Fe2O3,则氢氧化铁加热分解生成氧化铁,即氯化亚铁溶液中加入过量的氨水,有沉淀生成,沉淀为Fe(OH)2,后Fe(OH)2被氧化为Fe(OH)3,
故选C.
点评 本题考查金属及化合物的性质,为高频考点,把握物质的性质、发生的反应为解答本题的关键,侧重分析与应用的考查,注意红棕色固体为氧化铁,题目难度不大.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
20.5.4g 铝和足量的氢氧化钠溶液完全反应,在标准状况下生成氢气的体积是( )
| A. | 6.72L | B. | 4.48L | C. | 2.24L | D. | 1.12L |
18.下列说法中,正确的是( )
| A. | 等浓度CH3COOH溶液与NH3•H2O溶液等体积混合后,存在c(NH4+)+c(H+)=c(CH3COO-)+c(OH-) | |
| B. | 等浓度的HCl溶液与CH3COOH溶液中c(H+)也相同 | |
| C. | 向20mLHCl溶液中加入10mL同一浓度的HCl溶液时,其pH会改变 | |
| D. | 等浓度的CH3COOH溶液和NaOH溶液等体积混合后,溶液显中性 |
15.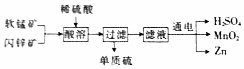 工业上可用软锰矿(主要成分MnO2)和闪锌矿(主要成分为ZnS)制备干电池中所需的MnO2和Zn,其工艺流程如图所示,下列说法中错误的是( )
工业上可用软锰矿(主要成分MnO2)和闪锌矿(主要成分为ZnS)制备干电池中所需的MnO2和Zn,其工艺流程如图所示,下列说法中错误的是( )
 工业上可用软锰矿(主要成分MnO2)和闪锌矿(主要成分为ZnS)制备干电池中所需的MnO2和Zn,其工艺流程如图所示,下列说法中错误的是( )
工业上可用软锰矿(主要成分MnO2)和闪锌矿(主要成分为ZnS)制备干电池中所需的MnO2和Zn,其工艺流程如图所示,下列说法中错误的是( )| A. | 上述流程中锰元素的价态没有变化 | |
| B. | 上述流程中的硫酸可循环利用 | |
| C. | 通电过程中,生成Zn单质时发生还原反应 | |
| D. | 通电过程中,阳极的电极反应式为Mn2+-2e-+2H2O═MnO2+4H+ |
2.下列变化不能通过一步反应实现的是( )
| A. | SO2→H2SO3 | B. | SiO2→H2SiO3 | C. | SO2→S | D. | S→SO3 |
19.已知:反应BeCl2+Na2BeO2+2H2O═2NaCl+2Be(OH)2↓能进行完全.以下推断中正确的是( )
| A. | BeCl2溶液pH<7,将其蒸干、灼烧后可得残留物BeCl2 | |
| B. | BeCl2水溶液的导电性强,BeCl2一定是离子晶体 | |
| C. | Be(OH)2能溶于盐酸,不能溶于NaOH溶液 | |
| D. | Na2BeO2溶液pH>7,将其蒸干、灼烧后可得残留物Na2BeO2 |
20.下列叙述正确的是( )
| A. | 固体SiO2一定是晶体 | |
| B. | 晶体有固定的组成,非晶体没有固定的组成 | |
| C. | 晶体内部的微粒按一定规律呈周期性有序排列 | |
| D. | 晶体的基本结构单元(晶胞)全部是平行六面体 |
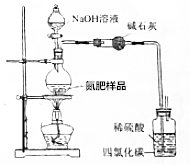 用如图所示装置测定氮肥[NH4HCO3中含(NH4)2CO3]中NH4HCO3的质量分数(不考虑铵盐溶液分解).
用如图所示装置测定氮肥[NH4HCO3中含(NH4)2CO3]中NH4HCO3的质量分数(不考虑铵盐溶液分解).