题目内容
18.下列说法中,正确的是( )| A. | 等浓度CH3COOH溶液与NH3•H2O溶液等体积混合后,存在c(NH4+)+c(H+)=c(CH3COO-)+c(OH-) | |
| B. | 等浓度的HCl溶液与CH3COOH溶液中c(H+)也相同 | |
| C. | 向20mLHCl溶液中加入10mL同一浓度的HCl溶液时,其pH会改变 | |
| D. | 等浓度的CH3COOH溶液和NaOH溶液等体积混合后,溶液显中性 |
分析 A、据电荷守恒分析;
B、盐酸是强酸,醋酸是弱酸;
C、HCl的浓度相同,两溶液混合后氢离子浓度不变;
D、等浓度的CH3COOH溶液和NaOH溶液等体积混合恰好生成CH3COONa.
解答 解:A、据电荷守恒,CH3COOH溶液与NH3•H2O溶液混合后,存在c(NH4+)+c(H+)=c(CH3COO-)+c(OH-),故A正确;
B、盐酸完全电离醋酸不完全电离,所以相同浓度的盐酸和醋酸溶液,盐酸溶液中氢离子浓度大,故B错误;
C、20mL同一浓度的HCl溶液中加入同浓度的盐酸,溶液中氢离子浓度不变,所以溶液的pH不变,故C错误;
D、CH3COONa溶液因醋酸根离子的水解导致溶液显碱性,故D错误;
故选A.
点评 本题考查了电解质溶液中的电荷守恒、强弱电解质、盐类水解相关知识,注意基础知识的掌握.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
9.下列各组离子能在溶液中大量共存的是( )
| A. | Fe3+、Cu2+、NO3-、S2- | B. | Fe2+、H+、Cl-、NO3- | ||
| C. | Fe3+、K+、Cl-、I- | D. | Fe2+、Fe3+、Cu2+、Cl- |
6.室温下,浓度均为0.5mol•L-1相同体积的下列四种溶液,其中所含阳离子数由多到少的顺序是( )
①KCl ②FeCl3③HF ④Na2CO3.
①KCl ②FeCl3③HF ④Na2CO3.
| A. | ④>①=②>③ | B. | ①>④>②>③ | C. | ④>①>③>② | D. | ④>②>①>③ |
3.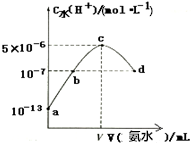 常温下,向20mL某浓度的硫酸中滴入0.1mol•L-1氨水,溶液中水电离出的氢离子浓度随加入氨水的体积变化如图所示.下列分析正确是( )
常温下,向20mL某浓度的硫酸中滴入0.1mol•L-1氨水,溶液中水电离出的氢离子浓度随加入氨水的体积变化如图所示.下列分析正确是( )
 常温下,向20mL某浓度的硫酸中滴入0.1mol•L-1氨水,溶液中水电离出的氢离子浓度随加入氨水的体积变化如图所示.下列分析正确是( )
常温下,向20mL某浓度的硫酸中滴入0.1mol•L-1氨水,溶液中水电离出的氢离子浓度随加入氨水的体积变化如图所示.下列分析正确是( )| A. | 该硫酸的浓度为1mol•L-1 | |
| B. | b点所示溶液中:c(NH4+)=2c(SO42-) | |
| C. | V=40 | |
| D. | c点所示溶液中:c(H+)-c(OH-)═c(NH3•H2O) |
10.向氯化亚铁溶液中加入过量的氨水,有沉淀生成.过滤.加热沉淀物至质量不再发声变化,得到红棕色的残渣.上述沉淀和残渣分别为( )
| A. | Fe(OH)2、Fe(OH)3;Fe3O4 | B. | Fe(OH)2;FeO | ||
| C. | Fe(OH)2、Fe(OH)3;Fe2O3 | D. | Fe2O3;Fe(OH)3 |
7.某溶液中Cl-、Br-、I-的物质的量之比为2:3:4.要使溶液中的Cl-、Br-、I-离子数之比变为4:3:2,则通入Cl2的分子数是原溶液中I-离子个数的( )
| A. | $\frac{1}{2}$ | B. | $\frac{1}{3}$ | C. | $\frac{1}{4}$ | D. | $\frac{1}{5}$ |
8.根据题目提供的溶度积数据进行计算并回答下列问题:
(1)已知25℃时,Ksp[Mg(OH)2]=5.6×10-12;酸碱指示剂百里酚蓝变色的pH范围如下:
25℃时,在Mg(OH)2饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为蓝色.
(2)向50mL0.018mol•L-1的AgNO3溶液中加入50mL0.020mol•L-1的盐酸,生成沉淀.已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液的体积变化,请计算:
①完全沉淀后,溶液中c(Ag+)=1.0×10-7 mol•L-1.
②完全沉淀后,溶液的pH=2.
③如果向完全沉淀后的溶液中继续加入50mL0.001mol•L-1的盐酸,是否有白色沉淀生成?否(填“是”或“否”).
(3)在某温度下,Ksp(FeS)=6.25×10-18,FeS饱和溶液中c(H+)与c(S2-)之间存在关系:c2(H+)•c(S2-)=1.0×10-22,为了使溶液里c(Fe2+)达到1mol•L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的c(H+)约为4×10-3mol/L.
(1)已知25℃时,Ksp[Mg(OH)2]=5.6×10-12;酸碱指示剂百里酚蓝变色的pH范围如下:
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
(2)向50mL0.018mol•L-1的AgNO3溶液中加入50mL0.020mol•L-1的盐酸,生成沉淀.已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液的体积变化,请计算:
①完全沉淀后,溶液中c(Ag+)=1.0×10-7 mol•L-1.
②完全沉淀后,溶液的pH=2.
③如果向完全沉淀后的溶液中继续加入50mL0.001mol•L-1的盐酸,是否有白色沉淀生成?否(填“是”或“否”).
(3)在某温度下,Ksp(FeS)=6.25×10-18,FeS饱和溶液中c(H+)与c(S2-)之间存在关系:c2(H+)•c(S2-)=1.0×10-22,为了使溶液里c(Fe2+)达到1mol•L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的c(H+)约为4×10-3mol/L.