题目内容
1.利用甲醇可以设计一个燃料电池.如图是一个电化学过程的示意图,用甲醇燃料电池给充电宝充电,并电解某盐溶液,其中充电宝锂离子电池的总反应为:xLi+Li1-xMn2O4$?_{充电}^{放电}$LiMn2O4请回答下列问题: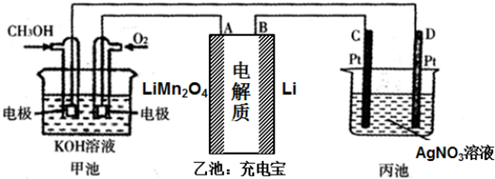
(1)写出甲池通入甲醇的电极的电极反应式CH3OH-6e-+8OH-=CO32-+6H2O.
(2)下列关于乙池的说法正确的是a
a.A极的电极反应式为LiMn2O4-xe-═Li1-xMn2O4+xLi+
b.B极发生氧化反应
c.乙池中Li+向A极移动
(3)理论上,当甲池中消耗标准状况下224mLO2时,丙池中某电极上增重4.32g.
分析 (1)甲装置中能发生自发的氧化还原反应,属于原电池,负极上燃料失电子;
(2)a.A与正极相连为阳极,阳极上LiMn2O4失电子;
b.B与负极相连为阴极;
c.电解时,阳离子向阴极移动;
(3)D与负极相连为阴极,阴极上银离子得电子生成Ag,根据电子守恒计算.
解答 解:(1)甲装置中能发生自发的氧化还原反应,属于原电池,碱性条件下,负极上甲醇失电子生成碳酸根离子和水,则电极方程式为:CH3OH-6e-+8OH-=CO32-+6H2O;
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
(2)a.A与正极相连为阳极,阳极上LiMn2O4失电子,则阳极的电极方程式为:LiMn2O4-xe-═Li1-xMn2O4+xLi+,故a正确;
b.B与通入甲醇的一极相连,即与负极相连为阴极,阴极上发生得电子的还原反应,故b错误;
c.A与正极相连为阳极,电解时,阳离子向阴极移动,即乙池中Li+向B极移动,故c错误;
故答案为:a;
(3)当甲池中消耗标准状况下224mL O2 时,即消耗氧气为$\frac{0.224L}{22.4L/mol}$=0.01mol,则转移电子为0.04mol,D与负极相连为阴极,阴极上银离子得电子生成Ag,转移0.04mol电子时生成0.04mol银,则银的质量为0.04mol×108g/mol=4.32g;
故答案为:4.32.
点评 本题考查化学电源新型电池和电解原理的应用,题目难度中等,本题注意根据电池总反应式正确判断电极反应,并能书写电极反应式是解答该题的关键.

练习册系列答案
相关题目
18.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 将2 mol NO和2 mol O2混合,充分反应后体系中原子总数为8NA | |
| B. | 将100 mL 0.1 mol•L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA | |
| C. | CO2通过Na2O2使其增重a g时,反应中转移的电子数为$\frac{a}{56}$NA | |
| D. | 100 g质量分数为9.8%的H2SO4水溶液中含氧原子数目为0.4NA |
12. 2016年诺贝尔化学奖由法国、美国及荷兰的三位化学家共同获得,以表彰他们在“分子马达”研究方面的成就.最初的“分子马达”的关键组件是三叠烯(如图),下列有关三叠烯的说法正确的是( )
2016年诺贝尔化学奖由法国、美国及荷兰的三位化学家共同获得,以表彰他们在“分子马达”研究方面的成就.最初的“分子马达”的关键组件是三叠烯(如图),下列有关三叠烯的说法正确的是( )
 2016年诺贝尔化学奖由法国、美国及荷兰的三位化学家共同获得,以表彰他们在“分子马达”研究方面的成就.最初的“分子马达”的关键组件是三叠烯(如图),下列有关三叠烯的说法正确的是( )
2016年诺贝尔化学奖由法国、美国及荷兰的三位化学家共同获得,以表彰他们在“分子马达”研究方面的成就.最初的“分子马达”的关键组件是三叠烯(如图),下列有关三叠烯的说法正确的是( )| A. | 分子式为C20H14 | B. | 属于苯的同系物 | ||
| C. | 能与溴水发生加成反应 | D. | 分子中所有原子可能在同一平面上 |
9.下列各组离子能在溶液中大量共存的是( )
| A. | Fe3+、Cu2+、NO3-、S2- | B. | Fe2+、H+、Cl-、NO3- | ||
| C. | Fe3+、K+、Cl-、I- | D. | Fe2+、Fe3+、Cu2+、Cl- |
16.在生产过程中,除去铁制品上的铁锈,可先用下列溶液洗涤的是( )
| A. | NaOH | B. | CuSO4 | C. | HCl | D. | NaCl |
6.室温下,浓度均为0.5mol•L-1相同体积的下列四种溶液,其中所含阳离子数由多到少的顺序是( )
①KCl ②FeCl3③HF ④Na2CO3.
①KCl ②FeCl3③HF ④Na2CO3.
| A. | ④>①=②>③ | B. | ①>④>②>③ | C. | ④>①>③>② | D. | ④>②>①>③ |
10.向氯化亚铁溶液中加入过量的氨水,有沉淀生成.过滤.加热沉淀物至质量不再发声变化,得到红棕色的残渣.上述沉淀和残渣分别为( )
| A. | Fe(OH)2、Fe(OH)3;Fe3O4 | B. | Fe(OH)2;FeO | ||
| C. | Fe(OH)2、Fe(OH)3;Fe2O3 | D. | Fe2O3;Fe(OH)3 |
11.用NA表示阿伏伽德罗常数的值,下列说法中正确的是( )
| A. | 常温常压下,36g18O2中所含的中子数为16NA | |
| B. | 1mol乙烯分子中含有共用电子对数为6NA | |
| C. | 电解饱和食盐水时,阳极上生成22.4L气体时转移的电子数为2NA | |
| D. | 标准状况下,2.24LCl2溶于水达到饱和,可得到HClO分子的数目是0.1NA |