题目内容
已知:(1)Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H1=-26.7kJ/mol
(2)3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H2=-50.75kJ/mol
(3)Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H3=-36.5kJ/mol
则反应:2FeO(s)+2CO(g)═2Fe(s)+2CO2(g)的△H= .
(2)3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H2=-50.75kJ/mol
(3)Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H3=-36.5kJ/mol
则反应:2FeO(s)+2CO(g)═2Fe(s)+2CO2(g)的△H=
考点:用盖斯定律进行有关反应热的计算
专题:化学反应中的能量变化
分析:根据盖斯定律将三个化学方程式进行处理得到2FeO(s)+2CO(g)═2Fe(s)+2CO2(g)的焓变.
解答:
解:由①×3-②-③×2得:6FeO(s)+6CO(g)═6Fe(s)+6CO2(g) ④
再由④÷3得:2FeO(s)+2CO(g)═2Fe(s)+2CO2(g)
故△H=
=
=+14.56 kJ?mol-1.
故答案为:+14.56 kJ?mol-1.
再由④÷3得:2FeO(s)+2CO(g)═2Fe(s)+2CO2(g)
故△H=
| 3△H1-△H2-2△H3 |
| 3 |
| 3×(-26.7kJ?mol-1)-(-50.75kJ?mol-1)-2×(-36.5kJ?mol-1) |
| 3 |
故答案为:+14.56 kJ?mol-1.
点评:本题考查反应热的计算,题目难度不大,注意盖斯定律的应用.

练习册系列答案
相关题目
下列说法在一定条件下可以实现的是( )
①酸性氧化物与碱发生反应;
②弱酸与盐溶液反应可以生成强酸;
③没有水生成,也没有沉淀和气体生成的复分解反应;
④两种酸溶液充分反应后的溶液体系为中性;
⑤有两种氧化物反应的产物有气体.
①酸性氧化物与碱发生反应;
②弱酸与盐溶液反应可以生成强酸;
③没有水生成,也没有沉淀和气体生成的复分解反应;
④两种酸溶液充分反应后的溶液体系为中性;
⑤有两种氧化物反应的产物有气体.
| A、①②③④⑤ | B、②④⑤ |
| C、①②③⑤ | D、③④⑤ |
已知:2C(s)+O2(g)═2CO(g)△H=-220 kJ?mol-1C(s)+H2O(g)═CO(g)+H2(g)△H=a kJ?mol-1且知H-H,O=O和O-H的键能分别为436kJ?mol-1,496kJ?mol-1,462kJ?mol-1,则a的值为( )
| A、-332 | B、-118 |
| C、+350 | D、+130 |
恒温、恒压下,1molA和amolB在一个容积可变的容器中发生如下反应:A(g)+2B(g)?2C(g). 一段时间后达到平衡,生成bmolC.则下列说法中正确的是( )
| A、当v正(A)═2v逆(C)时,可断定反应已达平衡 |
| B、起始时刻和达平衡后容器中的压强比为 1:1 |
| C、物质A、B的转化率之比为1:2 |
| D、若起始时放入2molA和2amolB,则达平衡时生成2bmolC |
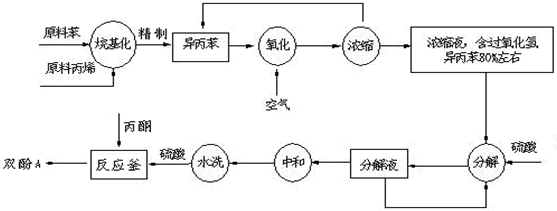
 (2)在氧化操作中,需要严格控制温度,防止温度过高.其原因是:①防止反应过于剧烈②
(2)在氧化操作中,需要严格控制温度,防止温度过高.其原因是:①防止反应过于剧烈②