题目内容
已知:2C(s)+O2(g)═2CO(g)△H=-220 kJ?mol-1C(s)+H2O(g)═CO(g)+H2(g)△H=a kJ?mol-1且知H-H,O=O和O-H的键能分别为436kJ?mol-1,496kJ?mol-1,462kJ?mol-1,则a的值为( )
| A、-332 | B、-118 |
| C、+350 | D、+130 |
考点:用盖斯定律进行有关反应热的计算,有关反应热的计算
专题:
分析:根据盖斯定律计算水分解反应的焓变,化学反应的焓变△H=H产物-H反应物再结合化学键能和物质能量的关系来回答.
解答:
解:已知①C(s)+H2O(g)═CO(g)+H2(g)△H=akJ?mol-1>0,
②2C(s)+O2(g)═2CO(g)△H=-220kJ?mol-1
①×2-②得:2H2O(g)═O2(g)+2H2(g)△H=(2a+220)kJ?mol-1>0,
4×462-496-2×436=2a+220,
解得a=+130.
故选D.
②2C(s)+O2(g)═2CO(g)△H=-220kJ?mol-1
①×2-②得:2H2O(g)═O2(g)+2H2(g)△H=(2a+220)kJ?mol-1>0,
4×462-496-2×436=2a+220,
解得a=+130.
故选D.
点评:本题考查学生盖斯定律的应用以及化学反应的能量和化学键键能之间的关系,注意知识的迁移和应用是关键,难度中等.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
设阿伏加德罗常数为NA,请你判断下列叙述中正确的是( )
| A、2NA个HF分子所占的体积约为44.8L |
| B、46 g四氧化二氮和二氧化氮的混合气体中含有的原子数少于3NA |
| C、常温常压下,8.8 gCO2和N2O混合气体中所含的电子数为4.4NA |
| D、5.6 g铁与500 mL 2 mol?L-1硝酸反应,转移的电子数为0.2NA |
下列有关物质分类正确的是( )
| A、液氯、冰水混合均为纯净物 |
| B、NO2、CO、CO2均为酸性氧化物 |
C、 与 与 互为同系物 互为同系物 |
| D、淀粉、纤维素和油脂都属于天然高分子化合物 |
已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ?mlo-1-1411.0kJ?mlo-1和-1366.8kJ?mlo-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
| A、-44.2kJ?mol-1 |
| B、+44.2kJ?mol-1 |
| C、-330kJ?mol-1 |
| D、+330kJ?mol-1 |
在m A(g)+n B(g)?p C(g)+q D(g)的反应中,(m、n、p、q为各物质的化学计量数),经5min达到平衡,测得:A增加3mol?L-1,B增加1mol?L-1,C减少2mol?L-1,此时若给体系加压,平衡不移动,则m:n:p:q为( )
| A、2:3:2:3 |
| B、2:2:3:3 |
| C、3:1:2:2 |
| D、3:1:2:3 |
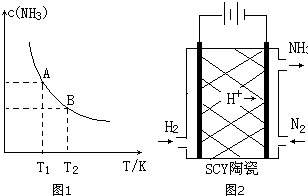 (1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%.
(1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%.