题目内容
已知:4Al(s)+3O2(g)=2Al2O3(s)△H=-2834.9KJ?mol-1
Fe2O3(s)+
C(s)=
CO2(g)+2Fe(s)△H=+234.1KJ?mol-1
C(s)+O2(g)=CO2(g)△H=-393.5KJ?mol-1
则2Al(s)+Fe2O3(s)=2Fe(s)+Al2O3(s)△H= .
Fe2O3(s)+
| 3 |
| 2 |
| 3 |
| 2 |
C(s)+O2(g)=CO2(g)△H=-393.5KJ?mol-1
则2Al(s)+Fe2O3(s)=2Fe(s)+Al2O3(s)△H=
考点:用盖斯定律进行有关反应热的计算
专题:
分析:根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,反应热也对应相应的系数进行加减,构造目标热化学方程式.
解答:
解:Ⅰ已知:①4Al(s)+3O2(g)=2Al2O3(s)△H=-2834.9KJ?mol-1
②Fe2O3(s)+
C(s)=
CO2(g)+2Fe(s)△H=+234.1KJ?mol-1
③C(s)+O2(g)=CO2(g)△H=-393.5KJ?mol-1
由盖斯定律可知,②-③×
+①×
得:2Al(s)+Fe2O3(s)=2Fe(s)+Al2O3(s)
△H=234.1KJ/mol-
×(-393.5KJ/mol)+
×(-2834.9KJ/mol)=-593.1KJ?mol-1;
故答案为:-593.1KJ?mol-1.
②Fe2O3(s)+
| 3 |
| 2 |
| 3 |
| 2 |
③C(s)+O2(g)=CO2(g)△H=-393.5KJ?mol-1
由盖斯定律可知,②-③×
| 3 |
| 2 |
| 1 |
| 2 |
△H=234.1KJ/mol-
| 3 |
| 2 |
| 1 |
| 2 |
故答案为:-593.1KJ?mol-1.
点评:考查根据盖斯定律计算反应热,难度中等,关键是构造目标热化学反应方程式,注意反应热的符号.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列离子方程式正确的是( )
A、等物质的量浓度的FeBr2和CuCl2混合溶液用惰性电极电解最初发生反应:Cu2++2Br-
| ||||
| B、碳酸氢镁溶液中加入足量的烧碱溶液:Mg2++2HCO3-+2OH-═MgCO3↓+CO32-+2H2O | ||||
| C、过量SO2通入氨水中:SO2+2NH3?H2O═2NH4++SO32-+H2O | ||||
| D、碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O |
下列有关物质分类正确的是( )
| A、液氯、冰水混合均为纯净物 |
| B、NO2、CO、CO2均为酸性氧化物 |
C、 与 与 互为同系物 互为同系物 |
| D、淀粉、纤维素和油脂都属于天然高分子化合物 |
如图是某物质发生化学反应的示意图,其中“ ”表示碳原子,“
”表示碳原子,“ ”表示氧原子,“
”表示氧原子,“ ”表示氢原子,则生成物甲的化学式为
”表示氢原子,则生成物甲的化学式为 ( )
( )
 ”表示碳原子,“
”表示碳原子,“ ”表示氧原子,“
”表示氧原子,“ ”表示氢原子,则生成物甲的化学式为
”表示氢原子,则生成物甲的化学式为 ( )
( )| A、H2 |
| B、CO2 |
| C、H2O |
| D、CO |
已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ?mlo-1-1411.0kJ?mlo-1和-1366.8kJ?mlo-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
| A、-44.2kJ?mol-1 |
| B、+44.2kJ?mol-1 |
| C、-330kJ?mol-1 |
| D、+330kJ?mol-1 |
在盛有AgCl沉淀的试管中加入KI溶液,振荡后可观察到白色沉淀逐渐转变为黄色沉淀.由这个实验可以说明( )
| A、I-的还原性比Cl-的强 |
| B、Cl-的半径比I-的小 |
| C、AgI的溶解度比AgCl的大 |
| D、实验过程中,平衡AgCl(s)?Ag+(aq)+Cl-(aq)不断向右移动 |
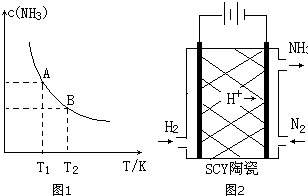 (1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%.
(1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%.