题目内容
恒温、恒压下,1molA和amolB在一个容积可变的容器中发生如下反应:A(g)+2B(g)?2C(g). 一段时间后达到平衡,生成bmolC.则下列说法中正确的是( )
| A、当v正(A)═2v逆(C)时,可断定反应已达平衡 |
| B、起始时刻和达平衡后容器中的压强比为 1:1 |
| C、物质A、B的转化率之比为1:2 |
| D、若起始时放入2molA和2amolB,则达平衡时生成2bmolC |
考点:化学平衡的计算
专题:化学平衡专题
分析:A.反应达平衡时,正逆反应速率相等,根据速率之比等于化学计量数之比判断;
B.起始时刻和达平衡后容器中的压强比等于物质的量之比;
C.A、B的转化率之比与b和a有关;
D.在恒压下,放入2molA和2amolB,与起始时1molA和amolB配比数相等,为等效平衡.
B.起始时刻和达平衡后容器中的压强比等于物质的量之比;
C.A、B的转化率之比与b和a有关;
D.在恒压下,放入2molA和2amolB,与起始时1molA和amolB配比数相等,为等效平衡.
解答:
解:A、当2v正(A)═v逆(C)时,正逆反应速率相等,反应达到平衡状态,故A错误;
B. A(g)+2B(g)?2C(g)
初始量:1 a 0
变化量:1.5b b b
平衡量:1-0.5b a-b b
则:起始时刻和达平衡后容器中的压强比为
=
>1,故B错误;
C.如a=2时,转化率相等,但题中a不确定,二者的转化率不能确定,故C错误;
D.在恒压下,放入3molA和3amolB,与起始时1molA和amolB配比数相等,为等效平衡,则达平衡时生成3bmolC,故D正确.
故选D.
B. A(g)+2B(g)?2C(g)
初始量:1 a 0
变化量:1.5b b b
平衡量:1-0.5b a-b b
则:起始时刻和达平衡后容器中的压强比为
| 1+a |
| 1-0.5b+a-b+b |
| 1+a |
| 1+a-0.5b |
C.如a=2时,转化率相等,但题中a不确定,二者的转化率不能确定,故C错误;
D.在恒压下,放入3molA和3amolB,与起始时1molA和amolB配比数相等,为等效平衡,则达平衡时生成3bmolC,故D正确.
故选D.
点评:本题考查化学平衡中平衡标志的判断,转化率、及等效平衡问题,题目难度不大,注意反应在恒压条件下进行的状态.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A、标准状况下,22.4LCCl4含有NA个分子 |
| B、0.1molAlCl3完全转化为胶体,生成胶体粒子的数目为0.l NA个 |
| C、常温常压下46gNO2和N2O4的混合气体含有3NA个原子 |
| D、0.1molCl2与足量冷的NaOH溶液反应,转移电子数为0.2 NA |
在盛有AgCl沉淀的试管中加入KI溶液,振荡后可观察到白色沉淀逐渐转变为黄色沉淀.由这个实验可以说明( )
| A、I-的还原性比Cl-的强 |
| B、Cl-的半径比I-的小 |
| C、AgI的溶解度比AgCl的大 |
| D、实验过程中,平衡AgCl(s)?Ag+(aq)+Cl-(aq)不断向右移动 |
溶液X中可能含有K+、Mg2+、Al3+、AlO2-、SiO32-、CO32-、SO32-、SO42-中的若干种离子.某同学对该溶液进行了如下实验:

下列判断正确的是( )

下列判断正确的是( )
| A、气体甲一定是纯净物 |
| B、沉淀乙为Mg(OH)2 |
| C、沉淀甲是硅酸和硅酸镁的混合物 |
| D、溶液X中一定存在K+、AlO2-和SiO32-离子 |
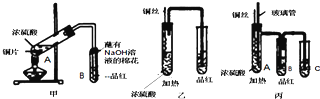
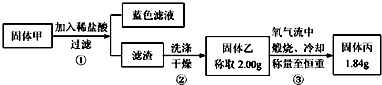
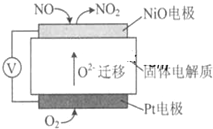 SO2、NOx是大气的主要污染物.
SO2、NOx是大气的主要污染物.