题目内容
滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等.沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂和被滴定物的生成物的溶解度要比滴定剂和指示剂生成物的溶解度小,否则不能用这种指示剂.如用AgNO3溶液滴定溶液中的Cl-的含量时常以CrO42-为指示剂,这是因为AgCl比Ag2CrO4更 (填“难”、“易”)溶的缘故.
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:只有当滴定剂和被滴定物的生成物的溶解度比滴定剂和指示剂的生成物的溶解度小时,反应能进行.
解答:
解:当滴定剂和被滴定物的生成物的溶解度比滴定剂和指示剂的生成物的溶解度小时,完全反应后,继续滴加滴定剂,滴定剂和指示剂反应生成沉淀,保证滴定剂和被滴定物完全反应,用AgNO3溶液滴定溶液中的Cl-的含量时常以CrO42-为指示剂,这是因为AgCl比Ag2CrO4更难溶,故答案为:难.
点评:本题考查难溶电解质的溶解平衡问题,题目以信息题的形式考查,注意把握题目信息.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
下列离子方程式正确的是( )
A、等物质的量浓度的FeBr2和CuCl2混合溶液用惰性电极电解最初发生反应:Cu2++2Br-
| ||||
| B、碳酸氢镁溶液中加入足量的烧碱溶液:Mg2++2HCO3-+2OH-═MgCO3↓+CO32-+2H2O | ||||
| C、过量SO2通入氨水中:SO2+2NH3?H2O═2NH4++SO32-+H2O | ||||
| D、碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O |
在m A(g)+n B(g)?p C(g)+q D(g)的反应中,(m、n、p、q为各物质的化学计量数),经5min达到平衡,测得:A增加3mol?L-1,B增加1mol?L-1,C减少2mol?L-1,此时若给体系加压,平衡不移动,则m:n:p:q为( )
| A、2:3:2:3 |
| B、2:2:3:3 |
| C、3:1:2:2 |
| D、3:1:2:3 |
用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A、标准状况下,22.4LCCl4含有NA个分子 |
| B、0.1molAlCl3完全转化为胶体,生成胶体粒子的数目为0.l NA个 |
| C、常温常压下46gNO2和N2O4的混合气体含有3NA个原子 |
| D、0.1molCl2与足量冷的NaOH溶液反应,转移电子数为0.2 NA |
在盛有AgCl沉淀的试管中加入KI溶液,振荡后可观察到白色沉淀逐渐转变为黄色沉淀.由这个实验可以说明( )
| A、I-的还原性比Cl-的强 |
| B、Cl-的半径比I-的小 |
| C、AgI的溶解度比AgCl的大 |
| D、实验过程中,平衡AgCl(s)?Ag+(aq)+Cl-(aq)不断向右移动 |
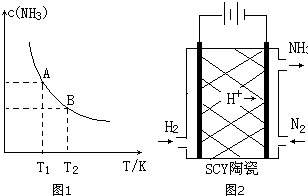 (1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%.
(1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%.