题目内容
在0.2L NaCl、MgCl2的混合溶液中,NaCl的物质的量浓度为0.5mol?L-1,MgCl2的物质的量浓度为1.0mol?L-1.回答下列问题:
(1)该混合溶液中氯离子的物质的量;
(2)该混合溶液中所含溶质的总质量;
(3)将该混合溶液加水稀释至溶液体积为1L,稀释后溶液中氯离子的物质的量浓度.
(1)该混合溶液中氯离子的物质的量;
(2)该混合溶液中所含溶质的总质量;
(3)将该混合溶液加水稀释至溶液体积为1L,稀释后溶液中氯离子的物质的量浓度.
考点:物质的量浓度的相关计算
专题:计算题
分析:(1)根据n=cV计算n(NaCl)、n(MgCl2),溶液中n(Cl-)=n(NaCl)+2n(MgCl2);
(2)根据m=nM计算;
(33)根据c=
计算稀释后溶液中氯离子的物质的量浓度.
(2)根据m=nM计算;
(33)根据c=
| n |
| V |
解答:
解:(1)n(NaCl)=0.2L×0.5mol/L=0.1mol,n(MgCl2)=0.2L×1mol/L=0.2mol,溶液中n(Cl-)=n(NaCl)+2n(MgCl2)=0.1mol+2×0.2mol=0.5mol,
答:溶液中氯离子物质的量为0.5mol;
(2)混合溶液中所含溶质的总质量为0.1mol×58.5g/mol+0.2mol×95g/mol=24.85g,
答:溶液中溶质的总质量为24.85g;
(3)溶液稀释到1L,稀释后溶液中氯离子的物质的量浓度为
=0.5mol/L,
答:稀释后溶液中氯离子物质的量浓度为0.5mol/L.
答:溶液中氯离子物质的量为0.5mol;
(2)混合溶液中所含溶质的总质量为0.1mol×58.5g/mol+0.2mol×95g/mol=24.85g,
答:溶液中溶质的总质量为24.85g;
(3)溶液稀释到1L,稀释后溶液中氯离子的物质的量浓度为
| 0.5mol |
| 1L |
答:稀释后溶液中氯离子物质的量浓度为0.5mol/L.
点评:本题考查物质的量有关计算,比较基础,注意对公式的理解与灵活应用.

练习册系列答案
相关题目
下列关于材料的说法不正确的是( )
| A、太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置 |
| B、二氧化硅可用作光导纤维 |
| C、石英玻璃耐强酸强碱,可用来制造化学仪器 |
| D、Si3N4是一种新型无机非金属材料,可用于制造发动机 |
某元素基态原子的外围电子排布为3d54s2,则下列说法不正确的是( )
| A、该元素为Mn元素 |
| B、该元素原子核外有4个能层 |
| C、该元素原子最外层共有7个电子 |
| D、该元素属于d区元素 |
设阿伏加德罗常数为NA,请你判断下列叙述中正确的是( )
| A、2NA个HF分子所占的体积约为44.8L |
| B、46 g四氧化二氮和二氧化氮的混合气体中含有的原子数少于3NA |
| C、常温常压下,8.8 gCO2和N2O混合气体中所含的电子数为4.4NA |
| D、5.6 g铁与500 mL 2 mol?L-1硝酸反应,转移的电子数为0.2NA |
设阿伏加德罗常数为6.02×1023mol-1,关于1molH2O的叙述正确的是( )
| A、含有1molH2 |
| B、含有6.02×1023个水分子 |
| C、质量为18g/mol |
| D、在标准状况下的体积为22.4L |
下列离子方程式正确的是( )
A、等物质的量浓度的FeBr2和CuCl2混合溶液用惰性电极电解最初发生反应:Cu2++2Br-
| ||||
| B、碳酸氢镁溶液中加入足量的烧碱溶液:Mg2++2HCO3-+2OH-═MgCO3↓+CO32-+2H2O | ||||
| C、过量SO2通入氨水中:SO2+2NH3?H2O═2NH4++SO32-+H2O | ||||
| D、碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O |
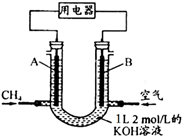 将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.
将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.