题目内容
10.锰及其化合物在生产、生活中有许多用途I.在实验室中模拟工业利用软锰矿(主要成分为MnO2,含少量SiO2、Fe2O3和A12O3等)制备金属锰等物质,设计流程如图:
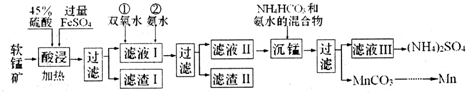
己知:碳酸锰在空气中高温加热固体产物为Mn2O3;部分氢氧化物的Ksp(近似值)如表.
| 物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
| Ksp | 10-13 | 10-17 | 10-39 | 10-33 |
(2)向滤液I 中滴加双氧水的目的是将Fe2+氧化为Fe3+,便于转化为Fe(OH)3除去;测得滤液I 中c(Mn2+)=0.1mol•L-1,为保证滴加氨水不产生Mn(OH)2,应控制溶液pH最大为8.
(3)“沉锰”过程中的离子方程式为Mn2++HCO3-+NH3•H2O=MnCO3↓+NH4++H2O.
(4)以碳酸锰和金属铝为原料可以制备粗锰,写出制备过程中最后一步反应的化学方程式Mn2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Mn.
Ⅱ.科学家发明了NH3燃料电池,以KOH为电解质,原理如图所示.
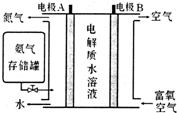
(5)该燃料电池的负极反应式为2NH3+6OH--6e-=N2+6H2O.
(6)以该电池为电源,用石墨电极电解锰酸钾(K2MnO4)溶液制取高锰酸钾,通电10分钟,电流强度为0.5A.最多可制得高锰酸钾0.49g(已知1mol电子所带电量为96500C).
分析 I.软锰矿用硫酸、硫酸亚铁溶解,二氧化硅不反应,由沉锰后得到碳酸锰,可知酸性条件下二氧化锰被亚铁离子还原为Mn2+,过滤分离,滤液I中加入过氧化氢,将Fe2+氧化为Fe3+,通入氨气调节溶液pH,将Fe3+、Al3+转化为Fe(OH)3、Al(OH)3除去,再过滤分离,滤液Ⅱ中加入碳酸氢铵与氨水的混合物得到碳酸锰,再过滤分离.
(1)“酸浸”中MnO2在酸性条件下被Fe2+还原为Mn2+,Fe2+被氧化生成Fe3+;
(2)滴加双氧水将Fe2+氧化为Fe3+,便于转化为Fe(OH)3除去;
结合Ksp[Mn(OH)2]=c(Mn2+)×c2(OH-)=10-13计算c(OH-),进而计算控制溶液pH;
(3)Mn2+与HCO3-、NH3•H2O反应生成MnCO3、NH4+与H2O;
(4)碳酸锰分解生成Mn2O3,Al与Mn2O3发生置换反应得到Mn;
Ⅱ.(5)负极发生氧化反应,由图可知,碱性条件下氨气失去电子生成氮气与水;
(6)计算转移电子物质的量,再根据电子转移守恒计算高锰酸钾的物质的量,进而计算其质量.
解答 解:I.软锰矿用硫酸、硫酸亚铁溶解,二氧化硅不反应,由沉锰后得到碳酸锰,可知酸性条件下二氧化锰被亚铁离子还原为Mn2+,过滤分离,滤液I中加入过氧化氢,将Fe2+氧化为Fe3+,通入氨气调节溶液pH,将Fe3+、Al3+转化为Fe(OH)3、Al(OH)3除去,再过滤分离,滤液Ⅱ中加入碳酸氢铵与氨水的混合物得到碳酸锰,再过滤分离.
(1)“酸浸”中MnO2在酸性条件下被Fe2+还原为Mn2+,Fe2+被氧化生成Fe3+,反应离子方程式为:MnO2+2Fe2++4H+$\frac{\underline{\;加热\;}}{\;}$Mn2++2Fe3++2H2O,
故答案为:MnO2+2Fe2++4H+$\frac{\underline{\;加热\;}}{\;}$Mn2++2Fe3++2H2O;
(2)滴加双氧水将Fe2+氧化为Fe3+,便于转化为Fe(OH)3除去,
滤液I 中c(Mn2+)=0.1mol•L-1,结合Ksp[Mn(OH)2]=c(Mn2+)×c2(OH-)=10-13,可知c(OH-)=$\sqrt{\frac{1{0}^{-13}}{0.1}}$mol/L=10-6mol/L,则溶液中c(H+)=$\frac{1{0}^{-14}}{1{0}^{-6}}$mol/L=10-8mol/L,此时溶液pH=-lg10-8=8,
故答案为:将Fe2+氧化为Fe3+,便于转化为Fe(OH)3除去;8;
(3)Mn2+与HCO3-、NH3•H2O反应生成MnCO3、NH4+与H2O,反应离子方程式为:Mn2++HCO3-+NH3•H2O=MnCO3↓+NH4++H2O,
故答案为:Mn2++HCO3-+NH3•H2O=MnCO3↓+NH4++H2O;
(4)碳酸锰分解生成Mn2O3,Al与Mn2O3发生置换反应得到Mn,制备过程中最后一步反应的化学方程式:Mn2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Mn,
故答案为:Mn2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Mn;
Ⅱ.(5)负极发生氧化反应,由图可知,碱性条件下氨气失去电子生成氮气与水,负极电极反应式为:2NH3+6OH--6e-=N2+6H2O,
故答案为:2NH3+6OH--6e-=N2+6H2O;
(6)转移电子物质的量为$\frac{600s×0.5A}{96500C/mol}$=$\frac{3}{965}$mol,根据电子转移守恒,生成高锰酸钾的物质的量为=$\frac{3}{965}$mol÷(7-6)=$\frac{3}{965}$mol,则生成高锰酸钾的质量为$\frac{3}{965}$mol×158g/mol≈0.49g,
故答案为:0.49.
点评 本题考查物质制备工艺流程、原电池与电解原理,属于拼合型题目,涉及陌生方程式书写、对原理的分析评价、条件控制、化学计算等知识点,是对学生综合能力的考查,注意电化学计算中电子转移守恒的运用.

| 选项 | 叙述 | 实验现象 | 解释 |
| A | 反萃取法提取碘的CCl4溶液中的碘 | 向富碘的CCl4溶液中加入足量水、振荡、静置、分液 | 碘在水中溶解度比在CCl4中大 |
| B | 在FeCl3溶液中加入适量Fe粉充分反应后,再滴加几滴黄色铁氰化钾溶液 | 产生蓝色沉淀 | 2Fe3++Fe═3Fe2+ 3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓ |
| C | 向0.1mol/L的Fe(NO3)2溶液中滴加盐酸 | 振荡试管颜色加深 | H+抑制Fe2+水解 |
| D | 让蛋白质从水溶液中析出 | 将CuSO4溶液加入蛋白质中发生盐析 | 重金属无机盐溶液可降低蛋白质的溶解度 |
| A. | A | B. | B | C. | C | D. | D |
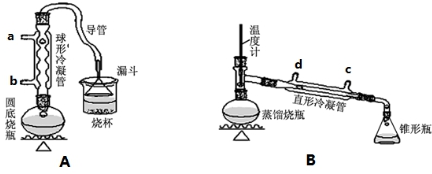
请回答下列问题:
(1)A装置中,在烧杯里的液面倒扣一个漏斗,其目的是既可以吸收充分,又可以防止倒吸.两个装置中都用到了冷凝管,A装置中冷水从b(填字母代号)进入,B装置中冷水从c(填字母代号)进入.
(2)制备操作中,加入的浓硫酸事先必须进行稀释,其目的是ab.(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成 c.水是反应的催化剂
(3)有同学拟通过红外光谱仪鉴定所得产物中是否含有“-CH2CH2CH2CH3”,来确定副产物中是否存在丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3).请评价该同学设计的鉴定方案是否合理?为什么?答:不合理,产物1-溴丁烷也含有-CH2CH2CH2CH3.
(4)为了进一步提纯1-溴丁烷,该小组同学查得相关有机物的有关数据如下表:
| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
| 选项 | 实验 | 现象 | 结论 |
| A | 将少量碳酸钙粉末加入到饱和NH4Cl溶液中 | 产生气体,粉末溶解 | NH4Cl水解使溶液呈酸性 |
| B | 将BaSO4固体粉末加入饱和Na2CO3溶液中,搅拌,过滤,洗涤,在滤渣中加入稀盐酸 | 产生气体,滤渣部分溶解 | Ksp(BaCO3)<Ksp(BaSO4) |
| C | 将黑色氧化铜粉末进行高温加热 | 黑色变成红色 | CuO分解生成铜单质 |
| D | 将某溶液滴加过量的稀盐酸 | 有刺激性气味气体产生,溶液中出现沉淀 | 溶液中一定存在S2-和SO32- |
| A. | A | B. | B | C. | C | D. | D |
| 选项 | 试剂 | 操作及现象 |
| A | AgNO3溶液 | 滴加氨水,产生沉淀;继续滴加氨水,沉淀溶解 |
| B | 铝粉 | 滴加NaOH溶液,产生气体;继续滴加,产生白色沉淀 |
| C | CuSO4溶液 | 加过量NaOH溶液,产生蓝色沉淀;再加乙醛,加热,产生红色沉淀 |
| D | 氯水 | 滴加NaOH溶液,溶液颜色褪去;再加HCl,溶液颜色恢复 |
| A. | A | B. | B | C. | C | D. | D |
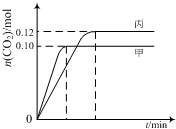 一定温度下,在三个容积均为2.0L的恒容密闭容器中发生反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)
一定温度下,在三个容积均为2.0L的恒容密闭容器中发生反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如下图所示:
| 容器 | 温度/℃ | 起始物质的量/mol | |
| NO (g) | CO (g) | ||
| 甲 | T1 | 0.20 | 0.20 |
| 乙 | T1 | 0.30 | 0.30 |
| 丙 | T2 | 0.20 | 0.20 |
| A. | 该反应的正反应为吸热反应 | |
| B. | 达到平衡时,乙中CO2的体积分数比甲中的小 | |
| C. | T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)<v(逆) | |
| D. | T2℃时,若起始时向丙中充入0.06mol N2和0.12 mol CO2,则达平衡时N2的转化率大于40% |
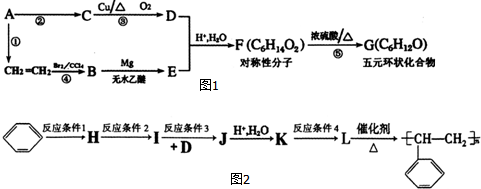
 .
.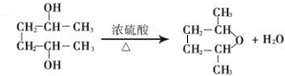 .
.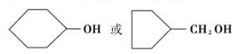 .
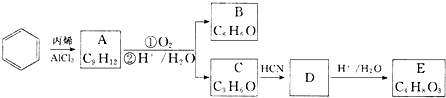
. .
.
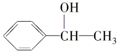
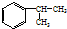 ,A的含有苯环的同分异构体(除A外)有7种.
,A的含有苯环的同分异构体(除A外)有7种.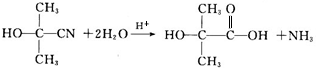 .
.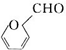 )是一种重要的化工原料,如同甲醛与苯酚反应生成酚醛树脂,它也可与苯酚反应生成糠醛树脂,写出该反应的化学方程式:
)是一种重要的化工原料,如同甲醛与苯酚反应生成酚醛树脂,它也可与苯酚反应生成糠醛树脂,写出该反应的化学方程式: .
. ,G
,G .
.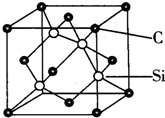 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答: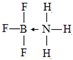 .
.