题目内容
3.下表中各栏目的叙述对应都正确的一项是( )| 选项 | 叙述 | 实验现象 | 解释 |
| A | 反萃取法提取碘的CCl4溶液中的碘 | 向富碘的CCl4溶液中加入足量水、振荡、静置、分液 | 碘在水中溶解度比在CCl4中大 |
| B | 在FeCl3溶液中加入适量Fe粉充分反应后,再滴加几滴黄色铁氰化钾溶液 | 产生蓝色沉淀 | 2Fe3++Fe═3Fe2+ 3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓ |
| C | 向0.1mol/L的Fe(NO3)2溶液中滴加盐酸 | 振荡试管颜色加深 | H+抑制Fe2+水解 |
| D | 让蛋白质从水溶液中析出 | 将CuSO4溶液加入蛋白质中发生盐析 | 重金属无机盐溶液可降低蛋白质的溶解度 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.根据相似相溶原理知,碘和四氯化碳都是非极性分子,水是极性分子,所以碘易溶于四氯化碳而不易溶于水;
B.亚铁离子和铁氰根离子发生络合反应生成蓝色沉淀;
C.酸性条件下,硝酸根离子能氧化亚铁离子生成铁离子;
D.重金属盐能使蛋白质发生变性.
解答 解:A.根据相似相溶原理知,碘和四氯化碳都是非极性分子,水是极性分子,所以碘易溶于四氯化碳而不易溶于水,向富碘的CCl4溶液中加入足量水、振荡、静置、分液,虽然碘在水中的溶解度低,但因为水的量大,导致碘溶于水中,但该实验不能说明碘易溶于水,故A错误;
B.亚铁离子和铁氰根离子发生络合反应生成蓝色沉淀,该实验现象及解释都正确,故B正确;
C.酸性条件下,硝酸根离子能氧化亚铁离子生成铁离子和NO,导致溶液颜色加深,与盐类水解无关,故C错误;
D.重金属盐能使蛋白质发生变性,硫酸铜属于重金属盐,使蛋白质发生变性,硫酸钠等盐溶液能使蛋白质发生盐析,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及蛋白质变性、硝酸的性质、亚铁离子检验等知识点,明确实验原理及物质性质是解本题关键,注意C中隐含条件的挖掘,为易错题.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
14.实验室中有一未知浓度的稀盐酸,某学生取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用浓度为0.1mol/L的标准NaOH溶液进行滴定.重复上述滴定操作2次,记录数据如下:
(1)滴定达到终点的现象是最后一滴氢氧化钠溶液加入,溶液由无色恰好变成浅红色,且半分钟内不褪色.此时锥形瓶内溶液的pH为8.2~10.
(2)根据上述数据,可计算出该盐酸的浓度约为0.11mol/L(保留两位有效数字).
(3)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有DF.(多选扣分)
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.称量前NaOH固体中混有Na2CO3固体
E.NaOH标准溶液部分与空气中的CO2反应生成了Na2CO3
F.碱式滴定管尖嘴部分有气泡,滴定后消失.
| 实验编号 | NaOH溶液体积(mL) | 待测盐酸的体积(mL) |
| 1 | 22.62 | 20.00 |
| 2 | 22.72 | 20.00 |
| 3 | 22.80 | 20.00 |
(2)根据上述数据,可计算出该盐酸的浓度约为0.11mol/L(保留两位有效数字).
(3)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有DF.(多选扣分)
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.称量前NaOH固体中混有Na2CO3固体
E.NaOH标准溶液部分与空气中的CO2反应生成了Na2CO3
F.碱式滴定管尖嘴部分有气泡,滴定后消失.
11.如图是部分短周期主族元素原子半径与原子序数的关系.下列说法正确的是( )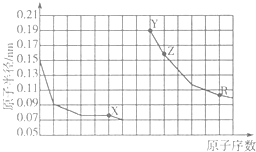

| A. | X、R的最简单氢化物的稳定性:X<R | |
| B. | X、Y、Z形成简单离子的半径大小:X>Y>Z | |
| C. | X、Y形成的化合物中只含有离子键 | |
| D. | Z单质着火可以用干冰进行灭火 |
18.水的电离常数如图两条曲线a与b所示,曲线中的点都符合c(H+)×c(OH-)=常数.下列说法正确的是( )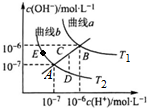

| A. | 图中温度T2>T1 | |
| B. | 曲线a、b均代表纯水的电离情况 | |
| C. | 图中五点的Kw的关系:B>C>A>D=E | |
| D. | 若处在B点时,将pH=2的硫酸溶液与pH=12的KOH溶液等体积混合后,溶液呈碱性 |
8.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1.8g H218O中含有的中子数为NA | |
| B. | 1mol Fe与足量的浓硫酸反应,生成SO2的分子数为NA | |
| C. | 7.1g Cl2溶于水所得溶液中含有的Cl-数目为0.1NA | |
| D. | 丙烷燃料电池负极消耗2.24L(标准状况)气体时,电路中转移电子数为2NA |
9.如图甲是利用一种微生物将废水中的尿素[CO(NH2)2]的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中不正确的是( )

| A. | 铜电极应与X相连接 | |
| B. | H+透过质子交换膜由左向右移动 | |
| C. | M电极反应式为CO(NH2)2+H2O-6e-═CO2↑+N2↑+6H+ | |
| D. | 当N电极消耗0.25 mol气体时,则理论上铁电极增重32 g |
10.锰及其化合物在生产、生活中有许多用途
I.在实验室中模拟工业利用软锰矿(主要成分为MnO2,含少量SiO2、Fe2O3和A12O3等)制备金属锰等物质,设计流程如图:
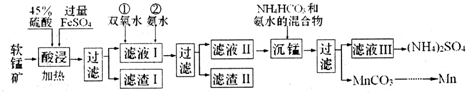
己知:碳酸锰在空气中高温加热固体产物为Mn2O3;部分氢氧化物的Ksp(近似值)如表.
(1)“酸浸”中MnO2反应的离子方程式为MnO2+2Fe2++4H+$\frac{\underline{\;加热\;}}{\;}$Mn2++2Fe3++2H2O.
(2)向滤液I 中滴加双氧水的目的是将Fe2+氧化为Fe3+,便于转化为Fe(OH)3除去;测得滤液I 中c(Mn2+)=0.1mol•L-1,为保证滴加氨水不产生Mn(OH)2,应控制溶液pH最大为8.
(3)“沉锰”过程中的离子方程式为Mn2++HCO3-+NH3•H2O=MnCO3↓+NH4++H2O.
(4)以碳酸锰和金属铝为原料可以制备粗锰,写出制备过程中最后一步反应的化学方程式Mn2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Mn.
Ⅱ.科学家发明了NH3燃料电池,以KOH为电解质,原理如图所示.
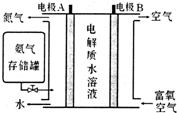
(5)该燃料电池的负极反应式为2NH3+6OH--6e-=N2+6H2O.
(6)以该电池为电源,用石墨电极电解锰酸钾(K2MnO4)溶液制取高锰酸钾,通电10分钟,电流强度为0.5A.最多可制得高锰酸钾0.49g(已知1mol电子所带电量为96500C).
I.在实验室中模拟工业利用软锰矿(主要成分为MnO2,含少量SiO2、Fe2O3和A12O3等)制备金属锰等物质,设计流程如图:

己知:碳酸锰在空气中高温加热固体产物为Mn2O3;部分氢氧化物的Ksp(近似值)如表.
| 物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
| Ksp | 10-13 | 10-17 | 10-39 | 10-33 |
(2)向滤液I 中滴加双氧水的目的是将Fe2+氧化为Fe3+,便于转化为Fe(OH)3除去;测得滤液I 中c(Mn2+)=0.1mol•L-1,为保证滴加氨水不产生Mn(OH)2,应控制溶液pH最大为8.
(3)“沉锰”过程中的离子方程式为Mn2++HCO3-+NH3•H2O=MnCO3↓+NH4++H2O.
(4)以碳酸锰和金属铝为原料可以制备粗锰,写出制备过程中最后一步反应的化学方程式Mn2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Mn.
Ⅱ.科学家发明了NH3燃料电池,以KOH为电解质,原理如图所示.

(5)该燃料电池的负极反应式为2NH3+6OH--6e-=N2+6H2O.
(6)以该电池为电源,用石墨电极电解锰酸钾(K2MnO4)溶液制取高锰酸钾,通电10分钟,电流强度为0.5A.最多可制得高锰酸钾0.49g(已知1mol电子所带电量为96500C).

 、
、 (写结构简式).
(写结构简式). .
. (写结构简式).
(写结构简式).