题目内容
A、B、C、D、E五种溶液分别是NaOH溶液、NH3?H2O溶液、CH3COOH溶液、HCl溶液、NH4HSO4溶液中的一种.常温下进行下列实验:
①将1L pH=3的A溶液分别与x L 0.001mol?L-1B溶液、y L 0.001mol?L-1D溶液充分反应至中性,x、y的大小关系为y<x;
②浓度均为0.1mol?L-1的A和E溶液中:pH(A)<pH(E);
③浓度均为0.1mol?L-1的C与D溶液等体积混合,溶液呈酸性.
回答下列问题:
(1)D是 ,判断理由是
(2)用水稀释0.1mol?L-1的B时,溶液中随着水量的增加而减小的是 (填序号,下同).
①
②
③c(H+)和c(OH-)的乘积 ④n(OH-)
(3)c(OH-)和体积均相等的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是 .
①反应所需要的时间:E>A
②开始反应时的速率:A>E
③参加反应的锌粉的物质的量:A=E
④反应过程的平均速率:E>A
⑤A溶液中有锌粉剩余
⑥E溶液中有锌粉剩余.
①将1L pH=3的A溶液分别与x L 0.001mol?L-1B溶液、y L 0.001mol?L-1D溶液充分反应至中性,x、y的大小关系为y<x;
②浓度均为0.1mol?L-1的A和E溶液中:pH(A)<pH(E);
③浓度均为0.1mol?L-1的C与D溶液等体积混合,溶液呈酸性.
回答下列问题:
(1)D是
(2)用水稀释0.1mol?L-1的B时,溶液中随着水量的增加而减小的是
①
| c(B) |
| c(OH-) |
| c(OH-) |
| c(H+) |
(3)c(OH-)和体积均相等的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是
①反应所需要的时间:E>A
②开始反应时的速率:A>E
③参加反应的锌粉的物质的量:A=E
④反应过程的平均速率:E>A
⑤A溶液中有锌粉剩余
⑥E溶液中有锌粉剩余.
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:根据中和酸性物质A只有NaOH、NH3?H2O,物质的量的A与等物质的量浓度B和D混合呈中性,D的用量少,说明D碱性比B的碱性强,所以D是NaOH,B为NH3?H2O;根据浓度均为0.1mol?L-1C与D溶液等体积混合,溶液呈酸性,则C为NH4HSO4;根据浓度均为0.1mol?L-1A和E溶液,pH:A<E,则A为HCl,E为CH3COOH;然后根据问题回答.
解答:
解:(1)中和酸性物质A只有NaOH、NH3?H2O,物质的量的A与等物质的量浓度B和D混合呈中性,D的用量少,说明D碱性比B的碱性强,所以D是NaOH溶液,根据浓度均为0.1mol?L-1C与D溶液等体积混合,溶液呈酸性,则C为NH4HSO4;
故答案为:NaOH溶液;中和酸性物质的A只有NaOH、NH3?H2O,等物质的量的A分别与等物质的量浓度的B和D混合呈中性,D的用量少,则说明D的碱性比B的碱性强,所以D是NaOH溶液;
(2)①、B溶液为氨水溶液,由NH3?H2O?OH-+NH4+可知,加水促进电离,则n(NH3?H2O)减少,n(OH-)增大,则
=
减小,故①正确;
②、由NH3?H2O?OH-+NH4+可知,加水促进电离,则n(NH3?H2O)减少,n(OH-)增大,c(NH3?H2O)、c(OH-)都减小,c(H+)减小,则
减小,故②正确;
③、因加水稀释时,温度不变,则c(H+)和c(OH-)的乘积不变,故③错误;
④、由NH3?H2O?OH-+NH4+可知,加水促进电离,OH-的物质的量增大,故④错误;
故答案为:①②;
(3)c(OH-)和体积均相等的两份溶液A和E,A为HCl,E为CH3COOH,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,醋酸是弱电解质存在电离平衡,所以醋酸溶液浓度大于盐酸浓度,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出的氢气的质量相同,只有强酸中剩余锌,
①反应所需要的时间醋酸短:E<A,故①错误;
②开始氢离子浓度相同,反应时的速率相同:A=E,故②错误;
③生成氢气相同,结合电子守恒,参加反应的锌粉的物质的量:A=E,故③正确;
④反应过程的平均速率,醋酸大于盐酸:E>A,故④正确;
⑤最后仅有一份溶液中存在锌粉,且放出的氢气的质量相同,只有强酸中剩余锌,A溶液中有锌粉剩余,故⑤正确;
⑥依据⑤分析可知E溶液中有锌粉剩余,故⑥错误;
故答案为:③④⑤.
故答案为:NaOH溶液;中和酸性物质的A只有NaOH、NH3?H2O,等物质的量的A分别与等物质的量浓度的B和D混合呈中性,D的用量少,则说明D的碱性比B的碱性强,所以D是NaOH溶液;
(2)①、B溶液为氨水溶液,由NH3?H2O?OH-+NH4+可知,加水促进电离,则n(NH3?H2O)减少,n(OH-)增大,则
| c(B-) |
| c(OH-) |
=
| c(NH3?H2O) |
| c(OH-) |
②、由NH3?H2O?OH-+NH4+可知,加水促进电离,则n(NH3?H2O)减少,n(OH-)增大,c(NH3?H2O)、c(OH-)都减小,c(H+)减小,则
| c(OH-) |
| c(H+) |
③、因加水稀释时,温度不变,则c(H+)和c(OH-)的乘积不变,故③错误;
④、由NH3?H2O?OH-+NH4+可知,加水促进电离,OH-的物质的量增大,故④错误;
故答案为:①②;
(3)c(OH-)和体积均相等的两份溶液A和E,A为HCl,E为CH3COOH,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,醋酸是弱电解质存在电离平衡,所以醋酸溶液浓度大于盐酸浓度,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出的氢气的质量相同,只有强酸中剩余锌,
①反应所需要的时间醋酸短:E<A,故①错误;
②开始氢离子浓度相同,反应时的速率相同:A=E,故②错误;
③生成氢气相同,结合电子守恒,参加反应的锌粉的物质的量:A=E,故③正确;
④反应过程的平均速率,醋酸大于盐酸:E>A,故④正确;
⑤最后仅有一份溶液中存在锌粉,且放出的氢气的质量相同,只有强酸中剩余锌,A溶液中有锌粉剩余,故⑤正确;
⑥依据⑤分析可知E溶液中有锌粉剩余,故⑥错误;
故答案为:③④⑤.
点评:本题考查电解质溶液之间的反应,沉淀溶解平衡的溶度积计算,涉及到强电解质、弱电解质的电离、盐类的水解及溶液的pH值、离子浓度大小的比较等知识,题目难度中等.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、用电解法精炼粗铜的时候纯铜做阳极 |
| B、将镁块与钢铁输水管相连,可以防止钢铁腐蚀 |
| C、熔融烧碱的时候,不能使用石英坩埚 |
| D、可以用硫酸或者CO2中和碱性废水 |
下列物质:①硫化钠溶液、②熟石膏、③碳酸钠晶体、④镁条、⑤漂白粉、⑥硫黄,暴露于空气中而不变质的有( )
| A、①、③ | B、②、⑤ |
| C、④、⑥ | D、③、④ |
取铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生0.896L NO2气体和0.672LN2O4的气体(气体体积都已折算到标准状况),在反应后的溶液中加足量的氢氧化钠溶液,生成沉淀质量为3.7g.则合金中铜与镁的物质的量之比等于( )
| A、1:1 | B、2:1 |
| C、2:3 | D、3:2 |
已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH?CH3COO-+H+,要使溶液中
值增大,可以采取的措施是( )
| c(H+) |
| c(CH3COOH) |
| A、加少量烧碱溶液 |
| B、加入金属锌 |
| C、加少量冰醋酸 |
| D、加水 |
下列关于电解质溶液的叙述正确的是( )
| A、常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Clˉ)>c(NH4+)>c(H+)=c(OHˉ) | ||
| B、在0.1mol?L-1 的NaHA溶液pH=4,则H2A为强酸 | ||
| C、pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊呈红色 | ||
D、向0.1mol?L-1的氨水中加少量硫酸铵固体,则溶液中
|


 (苯胺,易被氧化)
(苯胺,易被氧化) 有多种同分异构体,写出同时符合下列4个条件它的同分异构体的结构简式:
有多种同分异构体,写出同时符合下列4个条件它的同分异构体的结构简式: 的流程图:
的流程图: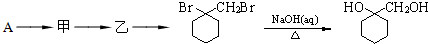 完成甲→乙的化学反应方程式:
完成甲→乙的化学反应方程式:
 为原料
为原料 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: