题目内容
2.下列各组粒子所含电子数目相同的是( )| A. | NH4+、OH-、H3O+ | B. | Na+、Mg2+、S2- | C. | F-、NH2-、Cl- | D. | Li+、Na+、K+ |
分析 根据原子的质子数相加即为微粒的质子数,利用质子数加负电荷数等于微粒的电子数,质子数减去正电荷数等于微粒的电子数来分析解答.
解答 解:A.NH4+的质子数为11、电子数为10,OH-的质子数为9、电子数为10,H3O+的质子数是11、电子数是10,电子数目相同,故A正确;
B.Na+的质子数为11、电子数为10,Mg2+的质子数为12、电子数为10,S2-的质子数是16、电子数是18,电子数目不相同,故B错误;
C.F-的质子数为9、电子数为10,NH2-的质子数为9、电子数为10,Cl-的质子数是17、电子数是18,电子数目不相同,故C错误;
D.Li+的质子数为3、电子数为2,Na+的质子数为11、电子数为10,K+的质子数是19、电子数是18,电子数目不相同,故D错误;
故选:A.
点评 本题考查微粒的质子数和电子数,明确质子数和电子数的计算及中性微粒中质子数等于电子数是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
12.某无色溶液中只含有:①K+、②Ba2+、③Cl-、④Br-、⑤SO32-、⑥SO42-中的一种或几种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
下列结论正确的是( )
| 步骤 | 操 作 | 现 象 |
| ① | 用pH试纸检验 | 溶液的pH大于7 |
| ② | 向溶液中滴加氯水,再加入CCl4振荡,静置 | CCl4层呈橙色 |
| ③ | 向②所得溶液中加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
| ④ | 将③过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
| A. | 可能含有的离子是①③⑥ | B. | 肯定没有的离子只有② | ||
| C. | 不能确定的离子只有⑤ | D. | 肯定含有的离子是①③④⑤ |
10.下列有关能量的叙述错误的是( )
| A. | 绿色植物进行光合作用时,将太阳能转化为化学能“储存”起来 | |
| B. | 物质发生化学反应过程中一定伴随着能量变化 | |
| C. | 可将反应“NaOH+HCl═NaCl+H2O”的化学能通过原电池转化为电能 | |
| D. | 化学反应使放热还是吸热,取决于生成物具有的总能量和反应物具有的总能量 |
17.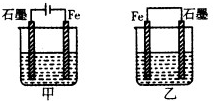 如图所示装置,均盛有等体积等浓度的稀硫酸,工作一段时间后当甲乙装置中通过电子的物质的量相同时,下列说法正确的是( )
如图所示装置,均盛有等体积等浓度的稀硫酸,工作一段时间后当甲乙装置中通过电子的物质的量相同时,下列说法正确的是( )
 如图所示装置,均盛有等体积等浓度的稀硫酸,工作一段时间后当甲乙装置中通过电子的物质的量相同时,下列说法正确的是( )
如图所示装置,均盛有等体积等浓度的稀硫酸,工作一段时间后当甲乙装置中通过电子的物质的量相同时,下列说法正确的是( )| A. | A、甲乙两装置中的石墨电极分别是阴极、负极 | |
| B. | 铁棒的腐蚀程度:甲>乙 | |
| C. | 石墨电极上发生反应的电极反应式相同 | |
| D. | 溶液的pH:甲减小,乙增大 |
7.下列说法错误的是( )
| A. | 双原子单质分子中的共价键一定是非极性键 | |
| B. | 含有离子键的化合物一定是离子化合物 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 在共价化合物中一定含有共价键 |
11.加热蒸发下列溶液,能析出得到原溶质的是( )
| A. | KNO3溶液 | B. | FeCl3溶液 | C. | Al2(SO4)3溶液 | D. | FeSO4溶液 |
 硫化钠是一种重要的化工原料.工业上用硫酸钠与碳反应得到硫化钠.反应方程式如下:
硫化钠是一种重要的化工原料.工业上用硫酸钠与碳反应得到硫化钠.反应方程式如下: H2S:
H2S: Na2O2:
Na2O2: .
.