题目内容
7.下列说法错误的是( )| A. | 双原子单质分子中的共价键一定是非极性键 | |
| B. | 含有离子键的化合物一定是离子化合物 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 在共价化合物中一定含有共价键 |
分析 A.同种非金属元素之间易形成非极性共价键;
B.离子化合物中一定含有离子键,可能含有共价键;
C.含有共价键的化合物可能是离子化合物;
D.只含共价键的化合物是共价化合物.
解答 解:A.同种非金属元素之间易形成非极性共价键,所以双原子单质分子中的共价健一定是非极性键,故A正确;
B.离子化合物中一定含有离子键,可能含有共价键,所以含有离子键的化合物的离子化合物,故B正确;
C.含有共价键的化合物可能是离子化合物,如KOH等,故C错误;
D.只含共价键的化合物是共价化合物,离子化合物中一定不含离子键,故D正确;
故选C.
点评 本题考查化合物和化学键的关系,明确物质的构成微粒即可判断化学键,注意离子键化合物和共价化合物的根本区别,不能根据是否含有金属元素判断离子化合物.

练习册系列答案
相关题目
15.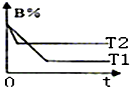 密闭容器中发生反应:A(g)+B(g)?C(g)△H.图中的两条曲线分别表示T1、T2温度下,体系中B的百分含量和时间t的关系.下列判断正确的是( )
密闭容器中发生反应:A(g)+B(g)?C(g)△H.图中的两条曲线分别表示T1、T2温度下,体系中B的百分含量和时间t的关系.下列判断正确的是( )
 密闭容器中发生反应:A(g)+B(g)?C(g)△H.图中的两条曲线分别表示T1、T2温度下,体系中B的百分含量和时间t的关系.下列判断正确的是( )
密闭容器中发生反应:A(g)+B(g)?C(g)△H.图中的两条曲线分别表示T1、T2温度下,体系中B的百分含量和时间t的关系.下列判断正确的是( )| A. | △H<0,T1<T2 | B. | △H>0,T1<T2 | C. | △H<0,T1>T2 | D. | △H>0,T1>T2 |
2.下列各组粒子所含电子数目相同的是( )
| A. | NH4+、OH-、H3O+ | B. | Na+、Mg2+、S2- | C. | F-、NH2-、Cl- | D. | Li+、Na+、K+ |
12.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.如表列出了①~⑨九种元素在周期表中的位置.
请回答:
(1)这九种元素分别是①C(填元素符号,下同)、②O、③Na、④Mg、⑤Al、⑥Cl、⑦Ar、⑧K、⑨Br,其中化学性质最不活泼的是Ar.
(2)在③④⑤三种元素的氧化物对应的水化物中,碱性最弱的是Al(OH)3(填化学式).
(3)①、②、③三种元素按原子半径由大到小的顺序依次为Na>C>O(填元素符号).
(4)⑥元素的氢化物是HCl(填化学式),该氢化物与④发生反应的化学方程式为2HCl+Mg=MgCl2+H2↑.
(5)⑧元素与⑥元素形成的化合物是KCl(填化学式),高温下灼烧该化合物时,火焰呈紫色.如何观察透过蓝色钴玻璃.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 4 | ⑧ | ⑨ |
(1)这九种元素分别是①C(填元素符号,下同)、②O、③Na、④Mg、⑤Al、⑥Cl、⑦Ar、⑧K、⑨Br,其中化学性质最不活泼的是Ar.
(2)在③④⑤三种元素的氧化物对应的水化物中,碱性最弱的是Al(OH)3(填化学式).
(3)①、②、③三种元素按原子半径由大到小的顺序依次为Na>C>O(填元素符号).
(4)⑥元素的氢化物是HCl(填化学式),该氢化物与④发生反应的化学方程式为2HCl+Mg=MgCl2+H2↑.
(5)⑧元素与⑥元素形成的化合物是KCl(填化学式),高温下灼烧该化合物时,火焰呈紫色.如何观察透过蓝色钴玻璃.
19.下列说法正确的是( )
| A. | 热的纯碱溶液去污能力强 | |
| B. | 硫酸钡、醋酸铵、氨水都是弱电解质 | |
| C. | 用Na2S溶液与AlCl3溶液混合制取Al2S3 | |
| D. | 碳酸钡和硫酸钡都可以用做钡餐 |
16.氯气是一种重要的工业原料,工业上利用反应3Cl2+2NH3═N2+6HCl检查氯气管道是否漏气,下列说法错误的是( )
| A. | 若管道漏气遇氨就会产生白烟 | B. | 该反应利用了Cl2的强氧化性 | ||
| C. | 该反应NH3被还原 | D. | 生成1 mol N2有6 mol电子转移 |
17.把1L 0.1mol/L醋酸溶液用蒸馏水稀释到10L,下列叙述正确的是( )
| A. | c(CH3COOH)变为原来的$\frac{1}{10}$ | B. | $\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的比值增大 | ||
| C. | c(H+)变为原来的$\frac{1}{10}$ | D. | 溶液的导电性增强 |
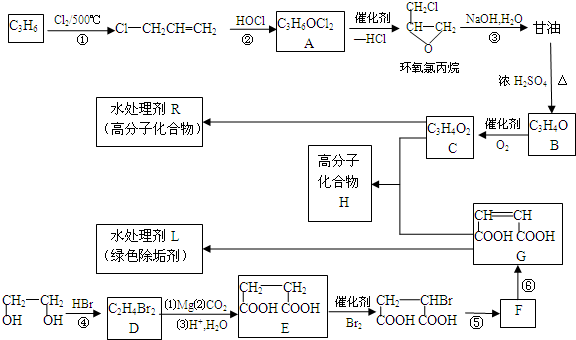
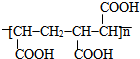 .
.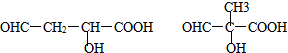
 的合成路线(无机原料任选).
的合成路线(无机原料任选).