��Ŀ����
13�� ������һ����Ҫ�Ļ���ԭ�ϣ���ҵ������������̼��Ӧ�õ����ƣ���Ӧ����ʽ���£�
������һ����Ҫ�Ļ���ԭ�ϣ���ҵ������������̼��Ӧ�õ����ƣ���Ӧ����ʽ���£�Na2SO4+2C$\stackrel{����}{��}$ Na2S+CO2��
���������գ�
��1��������Ӧ��Ԫ���У�ԭ�Ӱ뾶����Ԫ�ص�ԭ����4���ܼ���ͬ�ĵ��ӣ�
��2�����п���֤��������̼�ǷǼ��Է��ӵ�ʵ����ac�����ţ�
a�� ��¯�м��������ɱ������ӣ��ɱ��¶Ȳ��� b��������̼������ˮ
c��������̼�ڵ糡��ͨ����ƫ�� d��������̼���³�ѹ��Ϊ��̬
��3��������һ�������»������ʷ�Ӧ���ɶ����ƣ�Na2SX�����ڼ�����Һ�У�Na2SX��NaBrO3������Ӧ����Na2SO4��NaBr����Na2SX��NaBrO3��Ӧ�����ʵ���֮��Ϊ3��10���� x=3��
��4��д�����⻯������������ͭ��Һ��Ӧ�����ӷ���ʽ2HS-+Cu2+=CuS��+H2S����
�ܷ�������ͭ��Һ������������Һ�����⻯����Һ�������ʵ�����������˵���Լ��Ĺ۵㣺���ԣ��ֱ���������Һ�л�����������������ͭ��Һ�����������ݵ������⻯�ƣ��������������ƣ�
��5����֪��H2S Ki1=9.1��10-8 Ki2=1.1��10-12 HF Ki=3.5��10-4
H2SO3 Ki1=1.5��10-2 Ki2=1.0��10-7 HAc Ki=1.75��10-5
������ͼ��װ�ã������ƹ����������Һ��ȡ�������壬��ѡ�õ��Լ���b
a������ b������ c������� d�����������ƣ�
���� ��1������Ԫ����ԭ�Ӱ뾶������Na��������ԭ�ӵĵ����Ų�������
��2��a�� �Ǽ��Է�������¯�м���ʱ�¶Ȳ��䣻
b�����Է���Ҳ������ˮ��
c���Ǽ��Է����ڵ糡��ͨ��ʱ��ƫ��
d�����Է��ӳ��³�ѹ��Ҳ����Ϊ��̬��
��3��SԪ�ػ��ϼ���-$\frac{2}{x}$����Ϊ+6����NaBrO3����ԭΪNaBr��BrԪ�ػ��ϼ���+5�۽���Ϊ-1�ۣ���Ӧ��Na2Sx��NaBrO3�����ʵ���֮��Ϊ3��10������������ԭ��Ӧ��ת�Ƶ�����Ƚ��н��
��4�����⻯������������ͭ��Һ��Ӧ������ͭ���������⣻����������ͭ���ɳ��������⻯��������ͭ���ɳ��������壻
��5����������ǿ�������Ʊ������������ԭ���������������ǿ��ԭ���ܱ������������������
��� �⣺��1������Ԫ����ԭ�Ӱ뾶������Na����ԭ�ӵĵ����Ų�ʽΪ1s22s22p63s1����Naԭ����4���ܼ���ͬ�ĵ��ӣ�
�ʴ�Ϊ��4��
��2��a�� �Ǽ��Է�������¯�м���ʱ�¶Ȳ��䣬��֪��¯�м��������ɱ������ӣ��ɱ��¶Ȳ��䣬˵��������̼�ǷǼ��Է��ӣ���a��ȷ��
b�����Է���Ҳ������ˮ����HCl���ڼ��Է��ӣ�������ˮ����b����
c���Ǽ��Է��ӵ�������������ص������Ե��ԣ��ڵ糡��ͨ��ʱ��ƫ������̼�ڵ糡��ͨ����ƫ���������̼���ڷǼ��Է��ӣ���c��ȷ��
d�����Է��ӳ��³�ѹ��Ҳ����Ϊ��̬���簱����HCl�ȼ��Է����ڳ�����Ҳ�����壬��d����
�ʴ�Ϊ��ac��
��3��Na2Sx�ڼ�����Һ�пɱ�NaBrO3����ΪNa2SO4��SԪ�ػ��ϼ���-$\frac{2}{x}$����Ϊ+6����NaBrO3����ԭΪNaBr��BrԪ�ػ��ϼ���+5�۽���Ϊ-1�ۣ���Ӧ��Na2Sx��NaBrO3�����ʵ���֮��Ϊ3��10����x��[6-��-$\frac{2}{x}$��]��3=10��[5-��-1��]�����x=3��
�ʴ�Ϊ��3��
��4�����⻯������������ͭ��Һ��Ӧ������ͭ���������⣬�䷴Ӧ�����ӷ���ʽΪ��2HS-+Cu2+=CuS��+H2S��������������ͭ���ɳ��������⻯��������ͭ���ɳ��������壬������������ͭ��Һ������������Һ�����⻯����Һ��
�ʴ�Ϊ��2HS-+Cu2+=CuS��+H2S�������ԣ��ֱ���������Һ�л�����������������ͭ��Һ�����������ݵ������⻯�ƣ��������������ƣ�
��5�����볣��Խ������Խǿ���������ǿ��ԭ���ܱ���������������������Բ�������������������Ʊ������ᣬHF����ʢ���ڲ��������У����Բ���ѡ��HF��������ô����Ʊ������
�ʴ�Ϊ��b��
���� ���⿼������Ԫ�ؼ��仯��������ʣ���Ŀ�漰��֪ʶ��϶࣬�����ڿ���ѧ���Ի���֪ʶ���ۺ�Ӧ��������ע����յ����Ų����ɡ��Ǽ��Է��ӡ�������ԭ��Ӧԭ����Ӧ�����ʵļ������ȣ���Ŀ�Ѷ��еȣ�

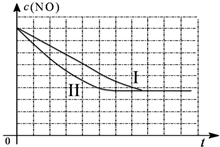
Ϊ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ���ij�¶��������崫������ò�ͬʱ���NO��COŨ�������
| ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | 5 |
| c��NO�� ��mol/L�� | 1.00��10-3 | 4.50��10-4 | 2.50��10-4 | 1.50��10-4 | 1.00��10-4 | 1.00��10-4 |
| c��CO�� ��mol/L�� | 3.60��10-3 | 3.05��10-3 | 2.85��10-3 | 2.75��10-3 | 2.70��10-3 | 2.70��10-3 |
��1��ǰ2s�ڵ�ƽ����Ӧ���ʦԣ�N2��=1.9��10-4mol/��L•s����CO��ƽ��ת����Ϊ25%���������������λ��Ч���֣�
��2��д���÷�Ӧ��ƽ�ⳣ��K�ı���ʽ$\frac{{c}^{2}��C{O}_{2}����c��{N}_{2}��}{{c}^{2}��NO����{c}^{2}��CO��}$��
��3���������ܱ������з���������Ӧ���ﵽƽ��ʱ���д�ʩ�����NOת���ʵ���CD��
A��ѡ�ø���Ч�Ĵ���B�����߷�Ӧ��ϵ���¶�
C�����ͷ�Ӧ��ϵ���¶�D����С���������
��4���о���������ʹ�õ���������ʱ����������ȱ���������ѧ��Ӧ���ʣ�ijͬѧ���������ʵ�飬ʵ�������Ѿ���������ʵ����Ʊ��У�
| ʵ�� ��� | T���棩 | NO��ʼŨ�� ��mol/L�� | CO��ʼŨ�� ��mol/L�� | �����ıȱ���� ��m2/g�� |
| �� | 280 | 1.20��10-3 | 5.80��10-3 | 82 |
| �� | 280 | 1.20��10-3 | 5.80��10-3 | 124 |
| �� | 350 | 1.20��10-3 | 5.80��10-3 | 124 |
�����ڸ���������ͼ�У������ϱ��еĵ�����ʵ�������»��������NOŨ����ʱ��仯����������ͼ��
��5����֪CO��ȼ����Ϊ284kJ/mol����N2��g��+O2��g���T2NO��g����H=+180kJ/mol����Ӧ2NO��g��+2CO��g��?2CO2��g��+N2��g����H=-748kJ/mol��
| A�� | �����£���ˮ���Ȼ�淋�pH=7�Ļ����Һ�У�c��Cl-��=c��NH4+�� | |
| B�� | ��NaHCO3��Һ�м�������NaOH���壬������HCO3-��ˮ�⣬ʹc��HCO3-������ | |
| C�� | 0.1 mol•L-1�ģ�NH4��2SO4��Һ�У�c��NH4+����c��SO42-����c��H+����c��OH-�� | |
| D�� | �����£������pH=a�Ĵ�����pH=b��NaOH��Һǡ���к�ʱ��a+b=14 |
| A�� | NH4+��OH-��H3O+ | B�� | Na+��Mg2+��S2- | C�� | F-��NH2-��Cl- | D�� | Li+��Na+��K+ |
Ni��OH��2+M�TNiOOH+MH ��֪��6NiOOH+NH3+H2O+OH-�T6Ni��OH��2+NO2-
����˵����ȷ���ǣ�������
| A�� | ��طŵ�����У������缫��ӦʽΪ��NiOOH+H2O+e-�TNi��OH��2+OH- | |
| B�� | �������������ĵ缫��Ӧʽ��H2O+M+e-�TMH+OH-��H2O�е�H��M��ԭ | |
| C�� | ��������OH-���Ӵ�����������Ǩ�� | |
| D�� | NiMH����п�����KOH��Һ����ˮ����Ϊ�������Һ |
 �״�ȼ�ϵ�أ�DNFC������Ϊ��21���͵綯������Ѻ�ѡ����Դ��
�״�ȼ�ϵ�أ�DNFC������Ϊ��21���͵綯������Ѻ�ѡ����Դ��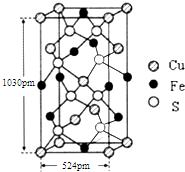 ��Ѫ�Σ������軯�أ�K4[Fe��CN��6]��������ˮ���㷺����ʳ�����Ӽ������������ʳ���л�Ѫ�ε����ʹ����Ϊ10mg•kg-1����Ѫ�ξ���ʱ�������400��ʱ��ֽ����ɾ綾���軯�أ��ش��������⣺
��Ѫ�Σ������軯�أ�K4[Fe��CN��6]��������ˮ���㷺����ʳ�����Ӽ������������ʳ���л�Ѫ�ε����ʹ����Ϊ10mg•kg-1����Ѫ�ξ���ʱ�������400��ʱ��ֽ����ɾ綾���軯�أ��ش��������⣺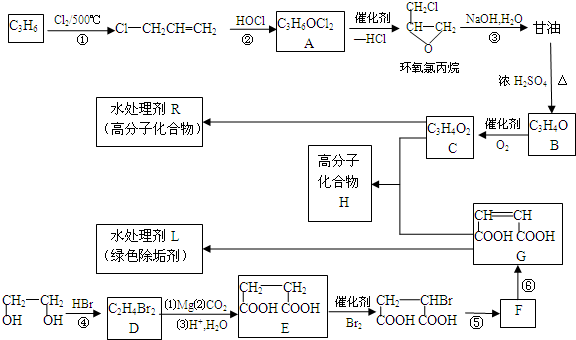
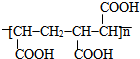 ��
��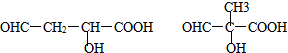
 �ĺϳ�·�ߣ���ԭ����ѡ����
�ĺϳ�·�ߣ���ԭ����ѡ����