题目内容
根据原子结构与元素周期律的知识,下列推断正确的是( )
| A、同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
| B、核外电子排布相同的微粒化学性质也相同 |
| C、Cl-、S2-、Ca2+、K+半径逐渐减小 |
| D、1735 Cl 与 1737 Cl 得电子能力相同 |
考点:元素周期律的作用
专题:元素周期律与元素周期表专题
分析:A.同主族元素最高价含氧酸自上而下酸性减弱;
B.核外电子排布相同的微粒,化学性质不一定相同,如Ar原子与S2-离子;
C.电子层结构相同,核电荷数越大离子半径越小;
D.互为同位素原子的化学性质几乎完全相同.
B.核外电子排布相同的微粒,化学性质不一定相同,如Ar原子与S2-离子;
C.电子层结构相同,核电荷数越大离子半径越小;
D.互为同位素原子的化学性质几乎完全相同.
解答:
解:A.同主族元素最高价含氧酸自上而下酸性减弱,不是最高价含氧酸不一定,如HClO为弱酸、HBrO4为强酸,故A错误;
B.核外电子排布相同的微粒,化学性质不一定相同,如Ar原子化学性质稳定,而S2-离子具有强还原性,故B错误;
C.S2-、Cl-、Ca2+、K+电子层结构相同,核电荷数越大离子半径越小,故离子半径S2->Cl->K+>Ca2+,故C错误;
D.3517Cl与3717Cl互为同位素,化学性质几乎完全相同,电子能力相同,故D正确,
故选D.
B.核外电子排布相同的微粒,化学性质不一定相同,如Ar原子化学性质稳定,而S2-离子具有强还原性,故B错误;
C.S2-、Cl-、Ca2+、K+电子层结构相同,核电荷数越大离子半径越小,故离子半径S2->Cl->K+>Ca2+,故C错误;
D.3517Cl与3717Cl互为同位素,化学性质几乎完全相同,电子能力相同,故D正确,
故选D.
点评:本题考查同主族元素性质递变规律、微粒半径比较、原子结构与性质关系等,难度不大,注意对基础知识的理解掌握.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
| A、1 mol NH3与1mol OH-所含的质子数均为10NA |
| B、常温下,pH=13的NaOH溶液中含OH-数目为NA |
| C、常温下,14g乙烯中含碳原子数为NA |
| D、标准状况下,22.4L CHCl3中含C-H键数目为NA |
室温下,将一元酸HA溶液和NaOH溶液等体积混合,实验数据如表:下列说法正确的是( )
| 实验编号 | 起始浓度c(HA) | 起始浓度c(NaOH) | 反应后溶液的pH |
| ① | 0.2mol?L-1 | 0.2mol?L-1 | 9 |
| A、HA是一元强酸 |
| B、反应后溶液中c(A-)>c(Na+) |
C、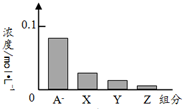 若用如图来表示反应后各微粒的关系,则图中X 表示OH-,Y表示HA,Z表示H+ |
| D、该混合溶液中:c(A-)+c(Y)>c(Na+) |
某无色溶液用惰性电极电解时,有如下两个实验现象:(1)阳极上有无色气体产生;(2)阴极上有白色沉淀生成;此溶液中可能大量共存的离子是( )
| A、Na+、Ba2+、NO3-、Cl- |
| B、NO3-、Mg2+、Na+、SO42- |
| C、CO32-、K+、Cl-、Na+ |
| D、Fe2+、NO3-、SO42-、Na+ |
将0.2mol/L的FeBr2与0.1mol/L FeI2溶液等体积混合后,慢慢通入一定体积的氯气,可能发生的离子反应方程式为( )
| A、Cl2+2Fe2+→2Cl-+2Fe3+ |
| B、2Cl2+2Fe2++2I-=2Fe3++4Cl-+I2 |
| C、3Cl2+2Fe2++4Br-→2Fe3++6Cl-+2Br2 |
| D、6Cl2+6Fe2++4I-+2Br-=6Fe3++12Cl-+2I2+Br2 |
试管中盛有白色晶体,检验它是不是铵盐的方法中不可行的是( )
| A、加热,将湿润的红色石蕊试纸放在管口 |
| B、加氢氧化钠溶液,加热,将湿润的酚酞试纸放在管口 |
| C、加氢氧化钠溶液,加热,将蘸有浓盐酸的玻璃棒放在管口 |
| D、加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在管口 |
下列大小顺序比较错误的是( )
| A、热稳定性:Na2CO3>NaHCO3>H2CO3 |
| B、相同pH的溶液,加水稀释后的pH:H2SO4>HCl>CH3COOH |
| C、离子半径:K+>Na+>Mg2+ |
| D、结合H+能力:OH->ClO->NO3- |






