题目内容
3-羟基丁酸 (3-hydroxybutyrate) 也称为β-羟基丁酸 (beta-hydroxybutyrate),在工业中可用于合成可生物降解的塑料,如聚(3-羟基丁酸).

已知:i.共轭二烯烃(如异戊二烯)与含有碳碳叁键的有机物作用时能形成环状化合物:

ii.
iii.步骤②只有一种产物;E的结构中含有甲基
(1)A分子结构简式 ;理论上B也可以由1,3-丁二烯与烃F来合成,则F的名称(系统命名法): ;C中含有的官能团是 (用符号表示).
(2)写出反应类型:② ,④ .
(3)PHB (填“有”或“无”)固定熔沸点;它与E (填“互为”或“不互为”)同分异构体.下列有机物具有类似共轭二烯烃性质的是 (填序号);
a.
b.
c.
d.
(4)写出反应⑤的化学方程式 .

已知:i.共轭二烯烃(如异戊二烯)与含有碳碳叁键的有机物作用时能形成环状化合物:

ii.

iii.步骤②只有一种产物;E的结构中含有甲基
(1)A分子结构简式
(2)写出反应类型:②
(3)PHB
a.

b.

c.

d.

(4)写出反应⑤的化学方程式
考点:有机物的推断
专题:有机物的化学性质及推断
分析:由转化关系可知,B发生信息ii反应生成C,C与氢气发生反应生成3-羟基丁酸,逆推可得C为CH3COCH2COOH,A与CH≡CH发生信息i反应生成B,则B为 ,A为
,A为 .3-羟基丁酸也可以通过两步反应形成另一种高聚物E,则应先发生消去反应生成CH3CH=CHCOOH,CH3CH=CHCOOH发生加聚反应得到E,故E为
.3-羟基丁酸也可以通过两步反应形成另一种高聚物E,则应先发生消去反应生成CH3CH=CHCOOH,CH3CH=CHCOOH发生加聚反应得到E,故E为 ;故3-羟基丁酸通过酯化反应进行的缩聚反应反应生成PHB,则PHB为
;故3-羟基丁酸通过酯化反应进行的缩聚反应反应生成PHB,则PHB为 ,据此解答.
,据此解答.
 ,A为
,A为 .3-羟基丁酸也可以通过两步反应形成另一种高聚物E,则应先发生消去反应生成CH3CH=CHCOOH,CH3CH=CHCOOH发生加聚反应得到E,故E为
.3-羟基丁酸也可以通过两步反应形成另一种高聚物E,则应先发生消去反应生成CH3CH=CHCOOH,CH3CH=CHCOOH发生加聚反应得到E,故E为 ;故3-羟基丁酸通过酯化反应进行的缩聚反应反应生成PHB,则PHB为
;故3-羟基丁酸通过酯化反应进行的缩聚反应反应生成PHB,则PHB为 ,据此解答.
,据此解答.解答:
解:由转化关系可知,B发生信息ii反应生成C,C与氢气发生反应生成3-羟基丁酸,逆推可得C为CH3COCH2COOH,A与CH≡CH发生信息i反应生成B,则B为 ,A为
,A为 .3-羟基丁酸也可以通过两步反应形成另一种高聚物E,则应先发生消去反应生成CH3CH=CHCOOH,CH3CH=CHCOOH发生加聚反应得到E,故E为
.3-羟基丁酸也可以通过两步反应形成另一种高聚物E,则应先发生消去反应生成CH3CH=CHCOOH,CH3CH=CHCOOH发生加聚反应得到E,故E为 ;故3-羟基丁酸通过酯化反应进行的缩聚反应反应生成PHB,则PHB为
;故3-羟基丁酸通过酯化反应进行的缩聚反应反应生成PHB,则PHB为 ,
,
(1)由上述分析可知,A为 ,B为
,B为 ,可以由1,3-丁二烯与CH3C≡CCH3通过加成反应合成,所以F为CH3C≡CCH3,F的名称2-丁炔,C为CH3COCH2COOH,含有的官能团是
,可以由1,3-丁二烯与CH3C≡CCH3通过加成反应合成,所以F为CH3C≡CCH3,F的名称2-丁炔,C为CH3COCH2COOH,含有的官能团是 、-COOH,
、-COOH,
故答案为: ;2-丁炔;
;2-丁炔; 、-COOH;
、-COOH;
(2)反应②属于氧化反应,反应④属于缩聚反应,
故答案为:氧化反应;缩聚反应;
(3)PHB是高聚物,分子中n值不同,为混合物,没有固定的熔点;PHB与E都属于高聚物,但n值不同,二者不是同分异构体,C=C双键通过C-C单键连接,具有类似共轭二烯烃性质,
a. 中不含不饱和键,不具有类似共轭二烯烃性质,故a不符合;
中不含不饱和键,不具有类似共轭二烯烃性质,故a不符合;
b. 中存在C=C双键通过C-C单键连接,具有类似共轭二烯烃性质,故b符合;
中存在C=C双键通过C-C单键连接,具有类似共轭二烯烃性质,故b符合;
c. 中不存在C=C双键通过C-C单键连接,不具有类似共轭二烯烃性质,故c不符合;
中不存在C=C双键通过C-C单键连接,不具有类似共轭二烯烃性质,故c不符合;
d. 中存在C=C双键通过C-C单键连接,具有类似共轭二烯烃性质,故d符合;
中存在C=C双键通过C-C单键连接,具有类似共轭二烯烃性质,故d符合;
故答案为:无;不互为;bd;
(4)反应⑤为:CH3CH(OH)CH2COOH
CH3CH=CHCOOH+H2O,
故答案为:CH3CH(OH)CH2COOH
CH3CH=CHCOOH+H2O.
 ,A为
,A为 .3-羟基丁酸也可以通过两步反应形成另一种高聚物E,则应先发生消去反应生成CH3CH=CHCOOH,CH3CH=CHCOOH发生加聚反应得到E,故E为
.3-羟基丁酸也可以通过两步反应形成另一种高聚物E,则应先发生消去反应生成CH3CH=CHCOOH,CH3CH=CHCOOH发生加聚反应得到E,故E为 ;故3-羟基丁酸通过酯化反应进行的缩聚反应反应生成PHB,则PHB为
;故3-羟基丁酸通过酯化反应进行的缩聚反应反应生成PHB,则PHB为 ,
,(1)由上述分析可知,A为
 ,B为
,B为 ,可以由1,3-丁二烯与CH3C≡CCH3通过加成反应合成,所以F为CH3C≡CCH3,F的名称2-丁炔,C为CH3COCH2COOH,含有的官能团是
,可以由1,3-丁二烯与CH3C≡CCH3通过加成反应合成,所以F为CH3C≡CCH3,F的名称2-丁炔,C为CH3COCH2COOH,含有的官能团是 、-COOH,
、-COOH,故答案为:
 ;2-丁炔;
;2-丁炔; 、-COOH;
、-COOH;(2)反应②属于氧化反应,反应④属于缩聚反应,
故答案为:氧化反应;缩聚反应;
(3)PHB是高聚物,分子中n值不同,为混合物,没有固定的熔点;PHB与E都属于高聚物,但n值不同,二者不是同分异构体,C=C双键通过C-C单键连接,具有类似共轭二烯烃性质,
a.
 中不含不饱和键,不具有类似共轭二烯烃性质,故a不符合;
中不含不饱和键,不具有类似共轭二烯烃性质,故a不符合;b.
 中存在C=C双键通过C-C单键连接,具有类似共轭二烯烃性质,故b符合;
中存在C=C双键通过C-C单键连接,具有类似共轭二烯烃性质,故b符合;c.
 中不存在C=C双键通过C-C单键连接,不具有类似共轭二烯烃性质,故c不符合;
中不存在C=C双键通过C-C单键连接,不具有类似共轭二烯烃性质,故c不符合;d.
 中存在C=C双键通过C-C单键连接,具有类似共轭二烯烃性质,故d符合;
中存在C=C双键通过C-C单键连接,具有类似共轭二烯烃性质,故d符合;故答案为:无;不互为;bd;
(4)反应⑤为:CH3CH(OH)CH2COOH
| 浓硫酸 |
| △ |
故答案为:CH3CH(OH)CH2COOH
| 浓硫酸 |
| △ |
点评:本题考查有机物的推断与合成,难度中等,需要学生对给予的选项进行利用,是有机题目热点题型,理解给予的信息是解题的关键,是对学生综合能力的考查,注意掌握官能团的性质.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
区分氢氧化铁胶体与含酚酞的稀氢氧化钠混合溶液最简便有效的方法是( )
| A、滴加盐酸 | B、丁达尔效应 |
| C、过滤 | D、蒸馏 |
下列有关化学用语正确的是( )
| A、聚丙烯的链节:-CH2-CH2-CH2- | ||
B、NH4Cl的电子式: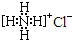 | ||
C、F-结构示意图: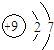 | ||
D、中子数为20的氯原子:
|
如图,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是( )
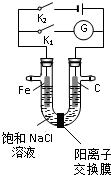

| A、K1闭合,铁棒侧溶液会出现白色沉淀,而且沉淀最终变为红褐色 |
| B、K1或K2闭合,石墨棒周围溶液pH均升高 |
| C、K2闭合,铁棒上发生的反应为2Cl--2e-=Cl2↑ |
| D、K2闭合,电路中通过0.002 NA个电子时,两极共产生0.002mol气体 |
根据原子结构与元素周期律的知识,下列推断正确的是( )
| A、同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
| B、核外电子排布相同的微粒化学性质也相同 |
| C、Cl-、S2-、Ca2+、K+半径逐渐减小 |
| D、1735 Cl 与 1737 Cl 得电子能力相同 |
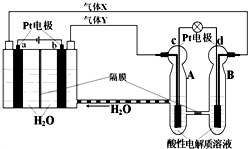 RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池,RFC工作原理见图.下列有关说法正确的是( )
RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池,RFC工作原理见图.下列有关说法正确的是( )| A、转移0.1mol电子时,a电极产生标准状况下O21.12L |
| B、b电极上发生的电极反应是:2H2O+2e-=H2↑+2OH- |
| C、c电极上进行还原反应,B池中的H+可以通过隔膜进入A池 |
| D、d电极上发生的电极反应是:O2+4H++4e-=2H2O |
已知25℃时Mg(OH)2的Ksp为5.6×10-12mol3?L-3,MgF2的Ksp为7.4×10-11mol3?L-3.下列说法中正确的是( )
| A、25℃时,Mg(OH)2固体在氨水中的Ksp比在NH4Cl溶液中的Ksp小 |
| B、25℃时,向Mg(OH)2的澄清饱和溶液中加入少量NH4Cl固体,c(Mg2+)减小 |
| C、25℃时,Mg(OH)2的溶解能力大于MgF2的溶解能力 |
| D、25℃时,饱和Mg(OH)2溶液与0.1mol?L-1NaF溶液等体积混合,能生成MgF2沉淀 |
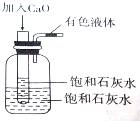 将一个装有饱和石灰水的试管放入盛有25℃饱和石灰水的广口瓶中,如图所示.
将一个装有饱和石灰水的试管放入盛有25℃饱和石灰水的广口瓶中,如图所示.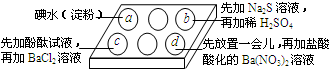 为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3 溶液,再分别滴加用如图所示的试剂对实验现象的“解释或结论”错误的是( )
为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3 溶液,再分别滴加用如图所示的试剂对实验现象的“解释或结论”错误的是( )