题目内容
某无色溶液用惰性电极电解时,有如下两个实验现象:(1)阳极上有无色气体产生;(2)阴极上有白色沉淀生成;此溶液中可能大量共存的离子是( )
| A、Na+、Ba2+、NO3-、Cl- |
| B、NO3-、Mg2+、Na+、SO42- |
| C、CO32-、K+、Cl-、Na+ |
| D、Fe2+、NO3-、SO42-、Na+ |
考点:离子共存问题
专题:
分析:无色溶液时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.该组离子用惰性电极电解时,阴极上不会生成白色沉淀;
B.NO3-、Mg2+、Na+、SO42-之间不发生反应,都是无色离子,且用惰性电极电解时阳极生成氧气、阴极生成氢氧化镁沉淀;
C.该组离子用惰性电极电解时,阴极上不会生成白色沉淀;
D.亚铁离子为有色离子,不满足溶液无色的条件.
A.该组离子用惰性电极电解时,阴极上不会生成白色沉淀;
B.NO3-、Mg2+、Na+、SO42-之间不发生反应,都是无色离子,且用惰性电极电解时阳极生成氧气、阴极生成氢氧化镁沉淀;
C.该组离子用惰性电极电解时,阴极上不会生成白色沉淀;
D.亚铁离子为有色离子,不满足溶液无色的条件.
解答:
解:A.Na+、Ba2+、NO3-、Cl-离子用惰性电极电解时,阴极上不会生成白色沉淀,故A错误;
B.NO3-、Mg2+、Na+、SO42-之间不发生反应,且都是无色离子,且用惰性电极电解时阳极生成氧气、阴极生成氢氧化镁沉淀,满足题干要求,故B正确;
C.CO32-、K+、Cl-、Na+离子用惰性电极电解时,阴极上不会生成白色沉淀,故C错误;
D.Fe2+为有色离子,不满足溶液无色的要求,故D错误;
故选B.
B.NO3-、Mg2+、Na+、SO42-之间不发生反应,且都是无色离子,且用惰性电极电解时阳极生成氧气、阴极生成氢氧化镁沉淀,满足题干要求,故B正确;
C.CO32-、K+、Cl-、Na+离子用惰性电极电解时,阴极上不会生成白色沉淀,故C错误;
D.Fe2+为有色离子,不满足溶液无色的要求,故D错误;
故选B.
点评:本题考查了离子共存的判断,题目难度中等,注意掌握离子反应发生条件,需要明确题干限制条件:无色溶液中不能存在有色离子、阳极上有无色气体产生、阴极上有白色沉淀生成,溶液中必须存在与氢氧根离子反应生成难溶物的离子.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
下列表示对应化学反应的离子方程式正确的是( )
| A、NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
| B、向40 mL 8 mol/L的稀硝酸溶液中加入5.6 g铁粉:Fe+4H++NO3-=Fe3++NO↑+2H2O |
| C、用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O |
| D、FeI2溶液中通入过量Cl2:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
下列叙述不正确的是( )
| A、0.1 mol?L-1NaOH溶液与0.2 mol?L-1CH3COOH溶液等体积混合后:c(CH3COOH)+c(CH3COO-)=0.2 mol?L-1 |
| B、常温下,将CH3COONa和HCl两溶液混合呈中性的溶液中:c(Na+)>c(Cl-)=c(CH3COOH) |
| C、pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4溶液,c(NH4+)大小顺序为①=②>③ |
| D、25℃时,pH=a的盐酸与pH=b的Ba(OH)2溶液等体积混合后,恰好完全反应,则a+b=14 |
如图,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是( )
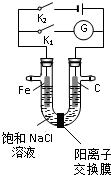

| A、K1闭合,铁棒侧溶液会出现白色沉淀,而且沉淀最终变为红褐色 |
| B、K1或K2闭合,石墨棒周围溶液pH均升高 |
| C、K2闭合,铁棒上发生的反应为2Cl--2e-=Cl2↑ |
| D、K2闭合,电路中通过0.002 NA个电子时,两极共产生0.002mol气体 |
化学与与生活密切相关,下列说法正确的是( )
| A、含有食品添加剂的食物对人体健康均有害 |
| B、普通玻璃和氮化硅陶瓷都属于新型无机非金属材料 |
| C、大力推广应用燃料“脱硫、脱硝”技术,可减少硫氧化物和氮氧化物对空气的污染 |
| D、为消除碘缺乏病,政府规定在食盐中必须添加一定量的KI |
根据原子结构与元素周期律的知识,下列推断正确的是( )
| A、同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
| B、核外电子排布相同的微粒化学性质也相同 |
| C、Cl-、S2-、Ca2+、K+半径逐渐减小 |
| D、1735 Cl 与 1737 Cl 得电子能力相同 |