题目内容
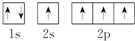
11.下列电子排布式或轨道表示式正确的是( )①C原子的轨道表示式:
②Cr原子的电子排布式:1s22s22p63s23p63d44s2
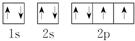
③O原子的轨道表示式:
④Br原子的外围电子排布式:3d104s24p5
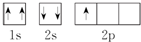
⑤B原子的轨道表示式:
| A. | ①②③ | B. | ②③④ | C. | ①②④⑤ | D. | 只有③ |
分析 遵循洪特规则、泡利不相容原理、能量最低原理的基态原子排布能量最低,以此分析.
①2s能级的能量比2p能量低,电子尽可能占据能量最低的轨道;
②Cr元素为24号元素,原子核外有24个电子,其电子排布式为1s22s22p63s23p63d54s1,则简易电子排布式为[Ar]3d54s1;
③根据原子核外电子排布原则:电子优先单独占据1个轨道,且自旋方向相同;
④主族元素原子的外围电子排布就是最外层电子数;
⑤每个轨道最多只能容纳两个电子,且自旋相反.
解答 解:①2s能级的能量比2p能量低,电子尽可能占据能量最低的轨道,所以2s上应有两个自方向相反的两个电子,故错误;
②Cr元素为24号元素,原子核外有24个电子,其电子排布式为1s22s22p63s23p63d54s1,则简易电子排布式为[Ar]3d54s1,违反能量最低原理,故错误;
③根据原子核外电子排布原则:电子优先单独占据1个轨道,且自旋方向相同,所以O原子的轨道表示式: ,故正确;
,故正确;
④主族元素原子的外围电子排布就是最外层电子数,所以Br原子的外围电子排布式:4s24p5,故错误;
⑤每个轨道最多只能容纳两个电子,且自旋相反,所以2s轨道应有2个自旋方向相反的电子,故错误;
故选D.
点评 本题考查基态原子核外电子排布规则,遵循洪特规则、泡利不相容原理、能量最低原理的基态原子排布能量最低,题目难度不大.

练习册系列答案
相关题目
8.某元素的原子结构示意图为 ,有关该元素的说法中,错误的是( )
,有关该元素的说法中,错误的是( )
 ,有关该元素的说法中,错误的是( )
,有关该元素的说法中,错误的是( )| A. | 原子的核内质子数为17 | B. | 原子的核外有3个电子层 | ||
| C. | 原子的最外层电子数为7 | D. | 属于金属元素 |
9.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 一定条件下,1 molN2与足量的氢气反应合成氨,转移的电子数为6 NA | |
| B. | 常温下,1.0LpH=13的氢氧化钡溶液中OH-的数目为0.2NA | |
| C. | 常温常压下,4.6 g的NO2和N2O4混合物中,含原子总数一定为0.3NA | |
| D. | 1L0.1mol/L Na2CO3溶液中含CO32-数目为0.1NA |
6.关于铝原子或铝离子的结构错误的是( )
| A. | 原子的最外层电子数等于电子层数 | |
| B. | 反应中可失去三个电子,比镁、钠还原性弱 | |
| C. | 失去电子的铝离子半径比铝原子小 | |
| D. | 铝离子比镁离子、钠离子的半径大 |
6.下列反应属于取代反应的是( )
| A. | 乙烯通入溴水中 | |
| B. | 乙烯通入酸性高锰酸钾溶液中 | |
| C. | 在水浴加热的条件下,苯与浓硝酸和浓硫酸混合液的反应 | |
| D. | 在镍做催化剂的条件下,苯与氢气反应 |
3.下列离子方程式的写法正确的是( )
| A. | 单质钠与水的反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 醋酸除水垢:2H++CaCO3═Ca2++H2O+CO2↑ | |
| C. | 氢氧化钡溶液和硫酸铜溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 稀硫酸与铁粉反应:Fe+2H+═Fe2++H2↑ |
1.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1molHCl溶液中,H+数目为NA | |
| B. | 常温常压下,8gCH4含有电子数目为5NA | |
| C. | 12gNaHSO4晶体中含有0.3NA个阳离子 | |
| D. | 78g苯含有C=C双键的数目为3 NA |