题目内容
9.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 一定条件下,1 molN2与足量的氢气反应合成氨,转移的电子数为6 NA | |
| B. | 常温下,1.0LpH=13的氢氧化钡溶液中OH-的数目为0.2NA | |
| C. | 常温常压下,4.6 g的NO2和N2O4混合物中,含原子总数一定为0.3NA | |
| D. | 1L0.1mol/L Na2CO3溶液中含CO32-数目为0.1NA |
分析 A、合成氨的反应为可逆反应;
B、pH=13的氢氧化钡溶液中,氢氧根浓度为0.1mol/L;
C、NO2和N2O4的最简式均为NO2;
D、碳酸根为弱酸根,在溶液中会水解.
解答 解:A、合成氨的反应为可逆反应,不能进行完全,故转移的电子数小于6NA个,故A错误;
B、pH=13的氢氧化钡溶液中,氢氧根浓度为0.1mol/L,故1L溶液中含0.1NA个氢氧根,故B错误;
C、NO2和N2O4的最简式均为NO2,故4.6g混合物中含0.1molNO2,故含0.3NA个原子,故C正确;
D、碳酸根为弱酸根,在溶液中会水解,故溶液中的碳酸根的个数小于0.1NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
19.已知HA、H2B为二种弱酸,HA的电离常数为KHA,H2B的电离常数为K1、K2,其大小依次是K1>KHA>K2,由此可以推测以下各反应中不能进行的是( )
| A. | NaA+H2B→NaHB+HA | B. | 2NaA+H2B→Na2B+2HA | ||
| C. | NaHB+HA→NaA+H2B | D. | Na2B+HA→NaHB+NaA |
17.化学与生产、生活、社会密切相关,下列有关说法正确的是( )
| A. | 光导纤维在信息领域应用越来越广泛,其主要成分是硅单质 | |
| B. | “地沟油”禁止食用,但可以用来制肥皂 | |
| C. | 明矾常用于水体杀菌消毒 | |
| D. | 中秋将至,为防止月饼等富脂食品氧化变质,常在包装袋中放入生石灰 |
1.下列叙述不正确的是( )
| A. | 化学反应释放或吸收能量的多少与发生反应的反应物的物质的量有关 | |
| B. | 人们可以利用氧化还原反应设计原电池以获取电能 | |
| C. | 人们可以利用C2H2(乙炔)与O2的化学反应获取热能或电能或光能 | |
| D. | MnO4-+5e-+8H+═Mn2++4H2O可能是某原电池里的负极反应 |
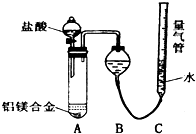 铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行探究.填写下列空白.
铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行探究.填写下列空白.