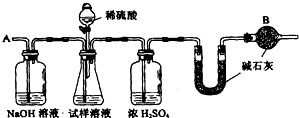
题目内容
20.由某物质R 和Na2SO4组成的混合固体放入足量的水中,充分搅拌,过滤后得到白色沉淀11.65g,经试验该白色沉淀不溶于稀硝酸,滤液呈碱性.加入稀盐酸中和滤液,当加入146g 浓度为5%的盐酸时溶液恰好成中性.求混合物中R 的质量(R不是氧化物).分析 Na2SO4溶液为中性,Na2SO4与Ba(OH)2反应生成硫酸钡不溶于硝酸,滤液含NaOH,溶液显碱性,结合HCl+NaOH=NaCl+H2O计算.
解答 解:Na2SO4溶液为中性,Na2SO4与Ba(OH)2反应生成硫酸钡不溶于硝酸,滤液含NaOH,溶液显碱性,则R为Ba(OH)2,
硫酸钡的物质的量为$\frac{11.65g}{233g/mol}$=0.05mol,则参加反应的氢氧化钡为0.05mol,生成NaOH为0.1mol,
HCl的物质的量为$\frac{146g×5%}{36.5g/mol}$=0.2mol,
由HCl+NaOH=NaCl+H2O可知,0.2molHCl中和NaOH,还中和0.05molBa(OH)2,
原混合物中Ba(OH)2为0.05mol+0.05mol=0.1mol,其质量为0.1mol×171g/mol=17.1g,
答:混合物中R 的质量为17.1g.
点评 本题考查混合物的计算,为高频考点,把握发生的反应、R的推断为解答的关键,侧重分析与计算能力的考查,注意氢氧化钡与硫酸钠、盐酸均反应,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.化学与生产、生活、社会密切相关,下列有关说法正确的是( )
| A. | 光导纤维在信息领域应用越来越广泛,其主要成分是硅单质 | |
| B. | “地沟油”禁止食用,但可以用来制肥皂 | |
| C. | 明矾常用于水体杀菌消毒 | |
| D. | 中秋将至,为防止月饼等富脂食品氧化变质,常在包装袋中放入生石灰 |
11.下列电子排布式或轨道表示式正确的是( )
①C原子的轨道表示式: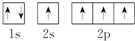
②Cr原子的电子排布式:1s22s22p63s23p63d44s2
③O原子的轨道表示式: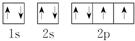
④Br原子的外围电子排布式:3d104s24p5
⑤B原子的轨道表示式: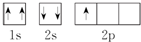
①C原子的轨道表示式:

②Cr原子的电子排布式:1s22s22p63s23p63d44s2
③O原子的轨道表示式:

④Br原子的外围电子排布式:3d104s24p5
⑤B原子的轨道表示式:

| A. | ①②③ | B. | ②③④ | C. | ①②④⑤ | D. | 只有③ |
8.下列说法中,正确的是( )
| A. | RCOOH与R′OH发生酯化反应时生成R′OOCR | |
| B. | 能与NaOH溶液反应,分子式为C2H4O2的有机物一定是羧酸 | |
| C. | 甲酸乙酯、乙酸甲酯、丙酸互为同分异构体 | |
| D. | 甲醛与乙酸乙酯的最简式相同 |
10.逻辑推理是化学学习中常用的一种思维方式,以下推理中正确的是( )
| A. | 化合物都是由不同元素组成的,故不同元素组成的物质一定是化合物 | |
| B. | 在金属活动性顺序表中排在氢元素前的金属能与酸反应放出氢气,金属镁排在氢的前面,所以金属镁一定与硝酸反应放出氢气 | |
| C. | 有新物质生成的变化属于化学变化,所以化学变化一定有新物质生成 | |
| D. | 单质都是由一种元素组成的,所以由一种元素组成的物质一定是单质 |