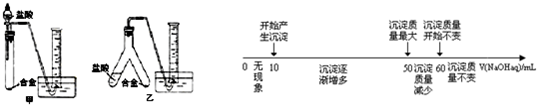
题目内容
3.下列离子方程式的写法正确的是( )| A. | 单质钠与水的反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 醋酸除水垢:2H++CaCO3═Ca2++H2O+CO2↑ | |
| C. | 氢氧化钡溶液和硫酸铜溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 稀硫酸与铁粉反应:Fe+2H+═Fe2++H2↑ |
分析 A.原子个数不守恒;
B.醋酸为弱酸,应保留化学式;
C.漏掉氢氧根离子与铜离子的反应;
D.二者反应生成硫酸亚铁和氢气.
解答 解:A.单质钠与水的反应,离子方程式:2Na+2H2O═2Na++2OH-+H2↑,故A错误;
B.醋酸除水垢,离子方程式:2CH3COOH+CaCO3═Ca2++H2O+CO2↑+2CH3COO-,故B错误;
C.氢氧化钡溶液和硫酸铜溶液反应,离子方程式:2OH-+Cu2++Ba2++SO42-═BaSO4↓+Cu(OH)2↓,故C错误;
D.稀硫酸与铁粉反应,离子方程式:Fe+2H+═Fe2++H2↑,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应离子方程式书写,注意化学式拆分,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列叙述不正确的是( )
| A. | 化学反应释放或吸收能量的多少与发生反应的反应物的物质的量有关 | |
| B. | 人们可以利用氧化还原反应设计原电池以获取电能 | |
| C. | 人们可以利用C2H2(乙炔)与O2的化学反应获取热能或电能或光能 | |
| D. | MnO4-+5e-+8H+═Mn2++4H2O可能是某原电池里的负极反应 |
11.下列电子排布式或轨道表示式正确的是( )
①C原子的轨道表示式: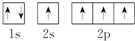
②Cr原子的电子排布式:1s22s22p63s23p63d44s2
③O原子的轨道表示式: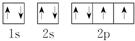
④Br原子的外围电子排布式:3d104s24p5
⑤B原子的轨道表示式: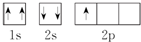
①C原子的轨道表示式:

②Cr原子的电子排布式:1s22s22p63s23p63d44s2
③O原子的轨道表示式:

④Br原子的外围电子排布式:3d104s24p5
⑤B原子的轨道表示式:

| A. | ①②③ | B. | ②③④ | C. | ①②④⑤ | D. | 只有③ |
8.下列说法中,正确的是( )
| A. | RCOOH与R′OH发生酯化反应时生成R′OOCR | |
| B. | 能与NaOH溶液反应,分子式为C2H4O2的有机物一定是羧酸 | |
| C. | 甲酸乙酯、乙酸甲酯、丙酸互为同分异构体 | |
| D. | 甲醛与乙酸乙酯的最简式相同 |
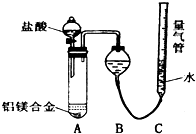 铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行探究.填写下列空白.
铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行探究.填写下列空白.