题目内容
1.下列说法正确的是( )| A. | 分子式为C3H6的有机物只有两种同分异构体 | |
| B. | 标准状况下,22.4 L CCl4的质量为154 g | |
| C. | 选用适当的催化剂,既可以改变化学反应速率,也可以改变反应物的平衡转化率 | |
| D. | 2 g H2(g)在O2(g)中完全燃烧生成H2O(l)放出热量为285.8 kJ,则该反应的热化学方程式可表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 |
分析 A、C3H6的有机物可能是丙烯和环丙烷;
B、标况下四氯化碳是液体;
C、使用催化剂,只改变反应速率,但平衡不移动;
D、2 g H2(g)是1mol,而不是2mol.
解答 解:A、C3H6的有机物可能是丙烯和环丙烷,所以分子式为C3H6的有机物只有两种同分异构体,故A正确;
B、标况下四氯化碳是液体,无法求物质的量,故B错误;
C、使用催化剂,只改变反应速率,但平衡不移动,所以反应物的平衡转化率不变,故C错误;
D、2 g H2(g)是1mol,而不是2mol,所以该反应的热化学方程式可表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,故D错误;
故选A.
点评 本题是道综合题,考查的知识点较多,难度不大,根据课本知识即可完成,需要注意的是使用催化剂,只改变反应速率,但平衡不移动.

练习册系列答案
相关题目
11.有碳原子数相同的烯烃、炔烃混合气xL,完全燃烧后生成yLCO2和zL水蒸气(温度、压强和原混合气相同),若x:y:z=3:6:4,则下列叙述正确的是( )
| A. | 原混合气为体积比为1:2的乙烯和乙炔 | |
| B. | 原混合气为体积比为1:1的丙烯和丙炔 | |
| C. | 原混合气为任意体积比的乙烯和乙炔 | |
| D. | 原混合气为体积比为1:2的乙烯和丙炔 |
12. 如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,反应原理是4Li+FeS2═Fe+2Li2S.下列说法正确的是( )
如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,反应原理是4Li+FeS2═Fe+2Li2S.下列说法正确的是( )
 如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,反应原理是4Li+FeS2═Fe+2Li2S.下列说法正确的是( )
如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,反应原理是4Li+FeS2═Fe+2Li2S.下列说法正确的是( )| A. | Li 发生氧化反应,a 极为阴极 | |
| B. | 电子由 a 极流出通过电流表流入 b 极,然后再由 b 极经内电路回到 a 极 | |
| C. | 可以用水代替 SO(CH3)2做溶剂 | |
| D. | b 极反应式是 FeS2+4Li++4e-═Fe+2Li2S |
9.食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的.
已知:①氧化性:IO3->Fe3+>I2;还原性:S2O32->I-;②KI+I2?KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为4份.第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色.
①向第四份试液中加K3Fe(CN)6溶液,根据是否得到具有特征蓝色的沉淀,可检验是否含有Fe2+(用离子符号表示).
②第二份试液中加入足量KI固体后,反应的离子方程式为:IO3-+5I-+6H+=3I2+3H2O、2Fe3++2I-=2Fe2++I2.
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失写出潮湿环境下KI与氧气反应的化学方程式:O2+4KI+2H2O=2I2+4KOH.
将I2溶于KI溶液,在低温条件下,可制得KI3•H2O.该物质不适合作为食盐加碘剂,其理由是KI3在受热(或潮湿)条件下产生I2和KI,KI被氧气氧化,I2易升华.
(3)某同学为探究温度和反应物浓度对反应2IO3-+5SO32-+2H+=I2+5SO42-+H2O的速率的影响,设计实验如下表所示:
表中数据:t1<t2(填“>”、“<”或“=”);表中V2=40mL.
已知:①氧化性:IO3->Fe3+>I2;还原性:S2O32->I-;②KI+I2?KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为4份.第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色.
①向第四份试液中加K3Fe(CN)6溶液,根据是否得到具有特征蓝色的沉淀,可检验是否含有Fe2+(用离子符号表示).
②第二份试液中加入足量KI固体后,反应的离子方程式为:IO3-+5I-+6H+=3I2+3H2O、2Fe3++2I-=2Fe2++I2.
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失写出潮湿环境下KI与氧气反应的化学方程式:O2+4KI+2H2O=2I2+4KOH.
将I2溶于KI溶液,在低温条件下,可制得KI3•H2O.该物质不适合作为食盐加碘剂,其理由是KI3在受热(或潮湿)条件下产生I2和KI,KI被氧气氧化,I2易升华.
(3)某同学为探究温度和反应物浓度对反应2IO3-+5SO32-+2H+=I2+5SO42-+H2O的速率的影响,设计实验如下表所示:
| 0.01mol•L-1KIO3 酸性溶液(含淀粉) 的体积/mL | 0.01mol•L-Na2SO3 溶液的体积/mL | H2O的 体积/mL | 实验 温度 /℃ | 溶液出现 蓝色时所 需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | t1 |
| 实验2 | 5 | 5 | 40 | 25 | t2 |
| 实验3 | 5 | 5 | V2 | 0 | t3 |
6. 一定条件下,下列各组物质能一步实现图所示转化关系的是( )
一定条件下,下列各组物质能一步实现图所示转化关系的是( )
 一定条件下,下列各组物质能一步实现图所示转化关系的是( )
一定条件下,下列各组物质能一步实现图所示转化关系的是( )| 选项 | X | Y | Z | W |
| A | Al | Al2O3 | NaAlO2 | Al(OH)3 |
| B | Fe3O4 | Fe | FeCl2 | FeCl3 |
| C | H2SO4 | SO2 | S | SO3 |
| D | CH3CH2Br | CH2═CH2 | C2H5OH | CH2BrCH2Br |
| A. | A | B. | B | C. | C | D. | D |
18.在0.1mol/L CH3COOH溶液中存在如下电离平衡:CH3COOH?CH3COO-+H+,对于该平衡,下列叙述正确的是( )
| A. | 加入少量0.1 mol/L HCl溶液,溶液中c(H+)不变 | |
| B. | 加入少量CH3COONa固体,平衡向正反应方向移动 | |
| C. | 加入水时,平衡向逆反应方向移动 | |
| D. | 加入少量NaOH固体,平衡向正反应方向移动 |
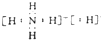 .
.