题目内容
6. 一定条件下,下列各组物质能一步实现图所示转化关系的是( )
一定条件下,下列各组物质能一步实现图所示转化关系的是( )| 选项 | X | Y | Z | W |
| A | Al | Al2O3 | NaAlO2 | Al(OH)3 |
| B | Fe3O4 | Fe | FeCl2 | FeCl3 |
| C | H2SO4 | SO2 | S | SO3 |
| D | CH3CH2Br | CH2═CH2 | C2H5OH | CH2BrCH2Br |
| A. | A | B. | B | C. | C | D. | D |
分析 A、Y(氧化铝)不能一步转化为W(氢氧化铝);
B、四氧化三铁通过铝热反应生成单质铁,铁与弱氧化剂盐酸反应生成氯化亚铁,铁与氯气生成氯化铁;FeCl2$\stackrel{氯气}{→}$FeCl3;FeCl3$\stackrel{铁}{→}$FeCl2;
C、Z(硫)不能一步转化为W(三氧化硫);
D、Z(C2H5OH)不能一步转化为W(CH2BrCH2Br);
解答 解:A、Y(氧化铝)不能一步转化为W(氢氧化铝),不符合条件,故A错误;
B、四氧化三铁通过铝热反应生成单质铁,铁与弱氧化剂盐酸反应生成氯化亚铁,铁与氯气生成氯化铁;FeCl2$\stackrel{氯气}{→}$FeCl3;FeCl3$\stackrel{铁}{→}$FeCl2,各步转化都可实现,故B正确;
C、Z(硫)不能一步转化为W(三氧化硫),不符合条件,故C错误;
D、Z(C2H5OH)不能一步转化为W(CH2BrCH2Br),要先消去,再加成,故D错误;
故选B.
点评 熟练掌握常见物质的性质及其转化关系,是解决此类问题所必须具备的知识基础.

练习册系列答案
相关题目
16.草酸钴用途广泛,可用于指示剂和催化剂的制备.一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4的工艺流程如下:
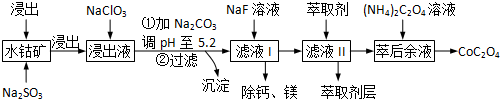
己知:,①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中加入Na2SO3的目的是将Fe3+、Co3+还原.
(2)NaClO3可将Fe2+氧化为Fe3+离子.可用氯气通入到热的浓氢氧化钠溶液来制取NaClO3.实验需要制取10.65克NaClO3,需要的氯气由电解食盐水生成,若不考虑反应过程中的损失,则同时生成的氢气的体积为6.72L(标准状况下).
(3)萃取剂对金属离子的萃取率与pH的关系如下图所示.使用萃取剂最适宜的pH是B(填选项序号).
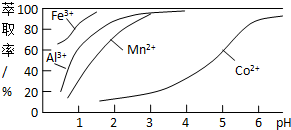
A.接近2.0 B.接近3.0 C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知某温度下,Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=0.7.
(5)为测定制得的无水草酸钴样品的纯度,现称取样品mg,先用适当试剂将其转化,得到纯净的草酸铵溶液,再用过量的稀硫酸酸化,用c mol/L高锰酸钾溶液去滴定,当溶液由无色变为浅紫色(或紫红色),且半分钟内不变色时(填颜色变化),共用去高锰酸钾溶液VmL,计算草酸钴样品的纯度为36.75cv/m%.

己知:,①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3可将Fe2+氧化为Fe3+离子.可用氯气通入到热的浓氢氧化钠溶液来制取NaClO3.实验需要制取10.65克NaClO3,需要的氯气由电解食盐水生成,若不考虑反应过程中的损失,则同时生成的氢气的体积为6.72L(标准状况下).
(3)萃取剂对金属离子的萃取率与pH的关系如下图所示.使用萃取剂最适宜的pH是B(填选项序号).

A.接近2.0 B.接近3.0 C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知某温度下,Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=0.7.
(5)为测定制得的无水草酸钴样品的纯度,现称取样品mg,先用适当试剂将其转化,得到纯净的草酸铵溶液,再用过量的稀硫酸酸化,用c mol/L高锰酸钾溶液去滴定,当溶液由无色变为浅紫色(或紫红色),且半分钟内不变色时(填颜色变化),共用去高锰酸钾溶液VmL,计算草酸钴样品的纯度为36.75cv/m%.
17.下列物质性质的比较,不能用元素周期律解释的是( )
| A. | 稳定性:H2O>NH3 | B. | 碱性:NaOH>Al(OH)3 | ||
| C. | 氧化性:F2>Cl2 | D. | 酸性:CH3COOH>H2CO3 |
14.下列是从海藻灰和智利硝石矿层中提取碘的主要反应:
①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2
下列说法正确的是( )
①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2
下列说法正确的是( )
| A. | 氧化性:MnO2>SO42->IO3->I2 | |
| B. | I2在反应①中是还原产物,在反应②中是氧化产物 | |
| C. | 反应①②中生成等量的I2时转移电子数之比为1:5 | |
| D. | NaHSO3溶液呈酸性,NaHSO3溶液中c(HSO3-)>c(H2SO3)>c(SO32-) |
1.下列说法正确的是( )
| A. | 分子式为C3H6的有机物只有两种同分异构体 | |
| B. | 标准状况下,22.4 L CCl4的质量为154 g | |
| C. | 选用适当的催化剂,既可以改变化学反应速率,也可以改变反应物的平衡转化率 | |
| D. | 2 g H2(g)在O2(g)中完全燃烧生成H2O(l)放出热量为285.8 kJ,则该反应的热化学方程式可表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 |
11.25℃时,下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1 mol•L-1NaHC2O4溶液(pH=5.5):c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| B. | 0.1 mol•L-1NaHS溶液:c(OH-)+c(S2-)=c(H+)+c(H2S) | |
| C. | 0.1 mol•L-1 NH4HSO4溶液中滴加0.1 mol•L-1 NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| D. | 0.1 mol•L-1CH3COOH溶液和0.1 mol•L-1CH3COONa溶液等体积混合:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) |
18.某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干种组成,取该溶液进行如下实验:
①取适量试液,加入过量盐酸,有气体生成,并得到澄清溶液;
②在①所得溶液中再加入过量碳酸氢铵溶液,有气体生成;同时析出白色沉淀甲;
③在②所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出.
根据对上述实验的分析判断,最后得出的结论合理的是( )
①取适量试液,加入过量盐酸,有气体生成,并得到澄清溶液;
②在①所得溶液中再加入过量碳酸氢铵溶液,有气体生成;同时析出白色沉淀甲;
③在②所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出.
根据对上述实验的分析判断,最后得出的结论合理的是( )
| A. | 不能判断溶液中是否存在SO42- | |
| B. | 溶液中一定不存在的离子是CO${\;}_{3}^{2-}$ | |
| C. | 不能判断溶液中是否存在Ag+ | |
| D. | 不能判断是否含有 AlO2- 离子 |
15.氯酸钾、火药及磷组成的混合物极易爆炸.由于KClO3受热分解释放出O2,引发白磷(P4,固体)的燃烧而导致火药爆炸.31gP4完全燃烧生成五氧化二磷固体释放出akJ热量.下列说法不正确的是( )
| A. | KClO3的分解过程中只有共价键断裂没有共价键生成 | |
| B. | 火药爆炸会使周围空气体积迅速膨胀 | |
| C. | 若白磷完全燃烧释放出8akJ热量,则需要标准状况下的O2体积为224L | |
| D. | 易燃易爆物应远离火源 |
3.用0.01mol•L-1 NaOH溶液完全中和pH=3的下列溶液各100mL.需NaOH溶液体积最大的是( )
| A. | 盐酸 | B. | 硫酸 | C. | 高氯酸 | D. | 醋酸 |