题目内容
12. 如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,反应原理是4Li+FeS2═Fe+2Li2S.下列说法正确的是( )
如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,反应原理是4Li+FeS2═Fe+2Li2S.下列说法正确的是( )| A. | Li 发生氧化反应,a 极为阴极 | |
| B. | 电子由 a 极流出通过电流表流入 b 极,然后再由 b 极经内电路回到 a 极 | |
| C. | 可以用水代替 SO(CH3)2做溶剂 | |
| D. | b 极反应式是 FeS2+4Li++4e-═Fe+2Li2S |
分析 该原电池中,Li易失电子作负极,所以a是负极、b是正极,负极反应式为Li-e-═Li+,LiPF6是电解质,则正极反应式为 FeS2+4Li++4e-═Fe+2Li2S,
A.该装置是原电池而不是电解池,所以电极为正负极而不是阴阳极;
B.电子从负极沿导线流向正极,电子不经过电解质;
C.水能和Li反应生成氢氧化锂;
D.正极上得电子发生还原反应.
解答 解:该原电池中,Li易失电子作负极,所以a是负极、b是正极,负极反应式为Li-e-═Li+,LiPF6是电解质,则正极反应式为 FeS2+4Li++4e-═Fe+2Li2S,
A.该装置是原电池而不是电解池,所以电极为正负极而不是阴阳极,Li失电子发生氧化反应,a是负极、b是正极,故A错误;
B.电子从负极沿导线流向正极,电子不经过电解质,电子从负极a沿导线流向正极b,电解质中通过阴阳离子定向移动形成电流,故B错误;
C.水能和Li反应生成氢氧化锂,所以不能用水作溶剂,故C错误;
D.正极上得电子发生还原反应,正极反应式为 FeS2+4Li++4e-═Fe+2Li2S,故D正确;
故选D.
点评 本题考查化学电源新型电池,为高频考点,侧重考查原电池原理,把握正负极判断、电子移动方向、电极反应式的书写是解本题关键,难点是电极反应式的书写,题目难度不大,易错选项是B.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
2.${\;}_{92}^{235}$U是制造原子弹和核发电的重要工业原料,关于铀元素的下列说法正确的是( )
| A. | ${\;}_{\;}^{235}$U的原子核外有143个电子 | B. | ${\;}_{\;}^{235}$U、${\;}_{\;}^{238}$U是同一种核素 | ||
| C. | ${\;}_{\;}^{235}$U一个原子中有92个中子 | D. | ${\;}_{\;}^{235}$U和${\;}_{\;}^{238}$U互为同位素 |
20.某化学科研小组对周围大气进行监测,发现该地区首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5微米的悬浮颗粒物),其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx灯进行研究具有重要意义.请回答下列问题:
(1)将PM2.5样品配成待测试样,若测得该试样所含水溶性无机离子的化学组分及平均浓度如下表:
根据表中数据计算该试样的pH=4.
(2))①为减少SO2的排放,可洗涤含SO2的烟气,作为洗涤剂下列物质最好选择a(填字母).
a.氨水 b.Na2CO3 c.O2 d.NaHSO3
②浓度均为0.1mol/L(NH4)2Fe(SO4)2、NH4HSO4、(NH4)2SO3,其中c(NH4+)最大的是(NH4)2Fe(SO4)2(填化学式).
(3)①已知汽缸中生成NO的反应为N2(g)+O2(g)?2NO(g)△H>0.汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是吸热反应,温度升高,平衡正向移动,NO的含量增大.
②汽车燃油不完全燃烧时产生CO,有人设计下列反应除去CO:2CO(g)═2C(s)+O2(g).已知该反应的△H>0,试判断该设想能否实现并简述理由否,因△H>0且△S<0,则在任何温度下△G>0,不可能自发进行.
(1)将PM2.5样品配成待测试样,若测得该试样所含水溶性无机离子的化学组分及平均浓度如下表:
| 离 子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2))①为减少SO2的排放,可洗涤含SO2的烟气,作为洗涤剂下列物质最好选择a(填字母).
a.氨水 b.Na2CO3 c.O2 d.NaHSO3
②浓度均为0.1mol/L(NH4)2Fe(SO4)2、NH4HSO4、(NH4)2SO3,其中c(NH4+)最大的是(NH4)2Fe(SO4)2(填化学式).
(3)①已知汽缸中生成NO的反应为N2(g)+O2(g)?2NO(g)△H>0.汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是吸热反应,温度升高,平衡正向移动,NO的含量增大.
②汽车燃油不完全燃烧时产生CO,有人设计下列反应除去CO:2CO(g)═2C(s)+O2(g).已知该反应的△H>0,试判断该设想能否实现并简述理由否,因△H>0且△S<0,则在任何温度下△G>0,不可能自发进行.
17.下列物质性质的比较,不能用元素周期律解释的是( )
| A. | 稳定性:H2O>NH3 | B. | 碱性:NaOH>Al(OH)3 | ||
| C. | 氧化性:F2>Cl2 | D. | 酸性:CH3COOH>H2CO3 |
4.下列实验操作及现象结论描述不准确的是( )
| A. | 向稀的苯酚水溶液中滴加少量稀溴水,先看到白色沉淀后沉淀消失,因为生成的三溴苯酚又溶于苯酚溶液中 | |
| B. | 向浓度均为0.1mol/L的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀,因为KSP[Mg(OH)2]>KSP[Cu(OH)2] | |
| C. | 利用以下实验器材(规格数量不限):烧杯、量筒、环形玻璃搅拌棒、纸条、硬纸板、温度计能完成中和反应反应热的测定 | |
| D. | 将实验室制乙烯的发生装置中制得的产物直接通入酸性高锰酸钾溶液,溶液褪色则说明乙烯有还原性 |
1.下列说法正确的是( )
| A. | 分子式为C3H6的有机物只有两种同分异构体 | |
| B. | 标准状况下,22.4 L CCl4的质量为154 g | |
| C. | 选用适当的催化剂,既可以改变化学反应速率,也可以改变反应物的平衡转化率 | |
| D. | 2 g H2(g)在O2(g)中完全燃烧生成H2O(l)放出热量为285.8 kJ,则该反应的热化学方程式可表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 |


 ,F
,F .
. .
. .
. .
.

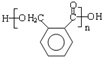 .由A生成B的反应过程中,会同时生成多种副产物,其中一种与B互为同分异构体,它的核磁共振氢谱有5个吸收峰.
.由A生成B的反应过程中,会同时生成多种副产物,其中一种与B互为同分异构体,它的核磁共振氢谱有5个吸收峰. .
.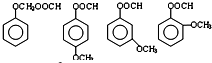 .
.